(共12分)钛是21世纪金属。下面是利用钛白粉(TiO2)生产海绵钛(Ti)的一种工艺流程:
已知:① Mg(s)+Cl2 (g)=MgCl2 (s) △H=-641 kJ·mol-1
② Cl2(g)+1/2Ti (s)=1/2TiCl4 (l) △H=-385 kJ·mol-1
(1)钛白粉是利用TiO2+发生水解生成钛酸(H2TiO3)沉淀,再煅烧沉淀制得的。
TiO2+发生水解的离子方程式为 。
(2)反应I在800~900℃下进行,还生成一种可燃性无色气体,该反应的化学方程式为 ;
反应II的热化学方程式为 。
(3)该工艺流程中,可以循环使用的物质有 (填化学式)。
(4)在800℃~1000℃时电解TiO2也可制得海绵钛,装置如右图所示。图中b是电源的 极,阴极的电极反应式为 。
(1)0.5L 0.5mol/L FeCl3溶液中的Cl-的物质的量浓度为 __________。
(2)在mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O g。
(3)中和相同体积、相同物质的量浓度的NaOH溶液,并使其生成正盐,需要相同物质的量浓度的盐酸、硫酸、磷酸溶液的体积比为。
(4 )今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、H+、Mg2+、Ba2+、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加入足量NaHCO3溶液后,收集到气体0.03mol。
②第二份加足量Ba(NO3)2溶液充分反应后过滤干燥,得干燥沉淀4.66g。
根据上述实验回答:
(a)原溶液中一定不存在的离子是_______________________。
(b)原溶液中可能存在的离子是_______________________。
(c)请计算出原溶液中一定存在的阴离子的物质的量浓度________________。
“滔滔”是我国第一例转入人体白蛋白基因的转基因试管牛,人们利用该转基因奶牛的乳汁能生产人类血清白蛋白。
(1)试管动物实际上是体外受精与胚胎移植两项技术的综合运用。体外受精前需要对奶牛的精子进行_________处理,方法是将精子放入一定浓度的_________或钙离子载体A23187溶液中。防止多精入卵的生理反应包括______________和________________。胚胎工程的终端环节是胚胎移植。移植后的胚胎能在受体子宫内存活的生理基础是___________________________________。
(2)人体白蛋白基因通常可以从基因文库中获取,含有一种生物所有基因的文库称为____________,获得人体白蛋白基因后可以利用________技术进行扩增。基因工程的核心步骤是______________________________。人体白蛋白基因一般利用____________技术导入牛的受精卵中,当受精卵分裂到囊胚期时,需要取囊胚的____________细胞进行性别鉴定,以确保发育成熟的牛能分泌乳汁。
现在大力提倡无纸化办公,但是仍然不可避免的每年要产生大量的废纸,其主要成分是木质纤维,人类正努力将其转化为一种新的资源——乙醇。右图是工业上利用微生物由纤维素生产乙醇的基本工作流程,请回答相关问题: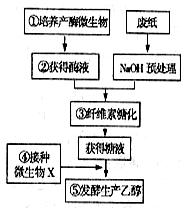
(1)自然界中①环节需要的微生物大多分布在
________________________的环境中。将从土壤中获得的微生物培养在以______________为碳源、并加入__________的培养基上筛选周围有___________的菌落。
(2)如上所述的筛选中获得了三个菌落,对它们分别培养,并完成环节②,且三种等量酶液中酶蛋白浓度相同,则你认为三种酶液的活性___________(一定相同、不一定相同、一定不同),可以通过对_______________________进行定量测定来验证。
(3)根据测定结果,①环节常选择木霉,则②中获得的酶是_____________酶。该酶至少包括__________、____________、________________三个组分。
(4)生产中可以满足④环节的常见菌种是___________,为了确保获得产物乙醇,⑤环节要注意_______________,④过程要注意避免________________________。
下图为蛋白质合成示意图(图中甲表示甲硫氨酸,丙表示丙氨酸),请据图分析:
(1)该图表示__________过程,组成②的单体是______________。
(2)丙氨酸的密码子是_________。若合成的蛋白质由570个氨基酸组成,那么与③对应的基因中有___________对碱基。
(3)图中④表示甲和丙之间的结合方式是_____________,甲和丙之间的化学键结构式是_____________。
(4)若③上的某一个碱基发生了改变,不一定引起相应的氨基酸的改变,因为____________________________________________________。
(5)该过程不可能发生在人的( )
| A.神经细胞 | B.肝细胞 | C.成熟的红细胞 | D.脂肪细胞 |
(1)小家鼠的正常尾与弯曲尾是一对相对性状(相关基因A、a只位于X染色体上),灰身(B)对黑身(b)为显性(B、b位于常染色体上)。现有10只基因型相同的灰身弯曲尾雌鼠和10只基因型相同的灰身弯曲雄鼠分别交配得到后代的类型和数量综合统计如下表:
| 灰身弯曲尾 |
灰身正常尾 |
黑身弯曲尾 |
黑身正常尾 |
|
| 雄鼠 |
76 |
74 |
24 |
26 |
| 雌鼠 |
149 |
0 |
51 |
0 |
请据上述杂交结果作出判断:
①写出雌雄亲本小鼠的基因型: 。
②在上述子代中,杂合灰身弯曲尾雌鼠占全部子代的比例为 。
③假如上述子代中的灰身雄鼠与黑身雌鼠杂交,后代中黑身小鼠所占比例为 。
(2)一只雌果蝇的一条染色体上某基因发生了突变,使野生型性状变为突变型性状。该雌果蝇与野生型雄果蝇杂交,F1的雌雄个体均既有野生型又有突变型。
①在野生型和突变型这对相对性状中,显性性状是 ,隐性性状是 。
②根据上述杂交实验的结果能否确定突变基因在X染色体上还是在常染色体上?请简要说明推断过程。_________________________________________________________________。
③若要通过一次杂交实验鉴别突变基因在X染色体上还是在常染色体上,最好选择F1中雌性为__________型,雄性为__________型作为杂交的亲本。请简要说明推断方法。__________________________________________________________________。