下图为蛋白质合成示意图(图中甲表示甲硫氨酸,丙表示丙氨酸),请据图分析:

(1)该图表示__________过程,组成②的单体是______________。
(2)丙氨酸的密码子是_________。若合成的蛋白质由570个氨基酸组成,那么与③对应的基因中有___________对碱基。
(3)图中④表示甲和丙之间的结合方式是_____________,甲和丙之间的化学键结构式是_____________。
(4)若③上的某一个碱基发生了改变,不一定引起相应的氨基酸的改变,因为____________________________________________________。
(5)该过程不可能发生在人的( )
| A.神经细胞 | B.肝细胞 | C.成熟的红细胞 | D.脂肪细胞 |
某学生用0.10 mol/L标准NaOH溶液滴定某浓度的盐酸。记录数据如下:
| 实验序号 |
待测液体积(mL) |
所消耗NaOH标准液的体积(mL) |
|
| 滴定前 |
滴定后 |
||
| 1 |
20.00 |
0.50 |
20.54 |
| 2 |
20.00 |
6.00 |
26.00 |
| 3 |
20.00 |
1.40 |
21.36 |
(1)滴定时选用酚酞试液作指示剂,如何判断滴定达到终点。
(2)盐酸的物质的量浓度为_____________
(3)碱式滴定管尖嘴部分有气泡,滴定后消失,对测定结果的影响是(填“偏高”或“偏低”或“无影响”,下同)。
(4)某同学用已知准确浓度的高锰酸钾溶液滴定溶液中Fe2+的浓度,高锰酸钾溶液应盛放在中(填“甲”或“乙”),该反应的离子方程式为:。
硝酸铵是含氮量较高的化肥,生产流程如下(产物水均已略去):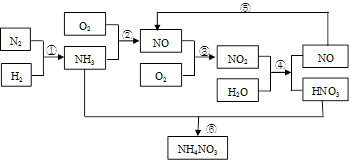
(1)反应④的化学方程式为3NO2+H2O = 2HNO3+NO,该反应的氧化剂为__________,还原剂为__________。
(2)补充并配平反应②的化学方程式:____NH3 +___O2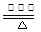 ____NO+ ________
____NO+ ________
(3)化学反应_______(填序号)是非氧化还原反应,离子方程式为_________________
(4)有人设计了一个反应来制备硝酸NO2+NH3 — HNO3+H2O(未配平),你认为该反应(填“能”或“不能”)发生,理由是______________________。
完成以下离子方程式或化学方程式:
(1)实验室制备氯气的离子方程式
(2)实验室制备氢氧化铝的离子方程式
(3)实验室制备氨气的化学方程式
(4)在实验室制备Fe(OH)2的过程中,常会出现白色沉淀迅速变成灰绿色,缓慢变成红褐色的现象。写出这步变化的化学方程式
现有下列4组物质:
| A.CaO、MgO、CO2、CuO | B.H2、Cl2、N2、Cu |
| C.O2、Fe、Cu、Zn | D.HCl、H2O、H2SO4、HNO3 |
(1)填写下表中的空白
| A组 |
B组 |
C组 |
D组 |
|
| 分类标准 |
金属氧化物 |
金属单质 |
||
| 不属于该类别的物质 |
Cu |
H2O |
(2)若上表中的4种物质相互作用可生成一种新物质——碱式碳酸铜[Cu2(OH)2CO3],写出该反应的化学方程式。
(1)已知工业上生产H2的过程中有如下反应: CO (g) + H2O (g) CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
CO2(g) + H2 (g)在一定条件下的密闭容器中,该反应达到化学平衡状态。请回答:
①恒容增大H2O (g)的物质的量,则CO的转化率(填“增大”或“减小”)。
②若升高温度能使化学平衡向正反应方向移动,则正反应是(填“放热”或“吸热”)反应。
③在某温度时,该反应10 min达到平衡,且有如下数据:
| 浓度物质 |
CO |
H2O |
CO2 |
H2 |
| 起始浓度/(mol·L-1) |
2.0 |
x |
0 |
0 |
| 平衡浓度/(mol·L-1) |
0.4 |
6.4 |
1.6 |
1.6 |
则上表中x=________________,该温度下平衡常数K的数值是____________。
(2)某化学实验小组的同学模仿工业上用离子交换膜法制烧碱的方法,设计出下图装置,通过电解硫酸钾溶液来制取氢气、氧气、硫酸和氢氧化钾。
①该电解槽的阳极反应式为。
②制得的氢氧化钾溶液从出口(填写“A”、“B”、“C”、“D”)_______导出。
③通电开始后,阴极附近溶液pH会增大,请简述原因 ____________________________________。