(1)0.5L 0.5mol/L FeCl3溶液中的Cl-的物质的量浓度为 __________。
(2)在 mL 0.2 mol/L NaOH溶液中含1 g溶质;配制50 mL 0.2 mol/L CuSO4溶液,需要CuSO4·5H2O g。
(3)中和相同体积、相同物质的量浓度的NaOH溶液,并使其生成正盐,需要相同物质的量浓度的盐酸、硫酸、磷酸溶液的体积比为 。
(4 )今有一混合物的水溶液,只可能含有以下离子中的若干种:K+、H+、Mg2+、Ba2+、CO32-、SO42-,现取两份100mL溶液进行如下实验:
①第一份加入足量NaHCO3溶液后,收集到气体0.03mol。
②第二份加足量Ba(NO3)2溶液充分反应后过滤干燥,得干燥沉淀4.66g。
根据上述实验回答:
(a)原溶液中一定不存在的离子是_______________________。
(b)原溶液中可能存在的离子是_______________________。
(c)请计算出原溶液中一定存在的阴离子的物质的量浓度________________。
氯碱工业是以电解食盐水为基础的基本化学工业,电解食盐水同时得到两种气体(气体A是所有气体中密度最小的气体,气体B是制取漂白粉的原料)和一种易溶、易电离的碱。
(1)试写出电解食盐水的化学方程式(注明反应条件)。
(2)试写出气体B与澄清石灰水反应的离子方程式。
下列为A、B、C、D四种物质的转化关系,a、b为反应条件,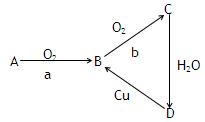
(1)若A为单质,a为点燃,b为催化剂、加热,则A为(填写化学式),
写出B→C的方程式。
(2)若A为气态化合物,B→C转化不需要条件,则A为(填写化学式),
写出A→B化学方程式 。
。
写出Cu+D溶液→B的离子方程式。
(3)把某黑色固体Y加热至红热,投入到上述某种无色溶液D中产生两种气体组成的混合气体X,将X做如下所示实验:
写出M、G所代表物质的化学式MG
A、B、C、D、E五种常见物质,均为可溶于水的固体,两种物质的焰色反应为黄色,且二者 的溶液混合会产生无色无味气体。组成它们的离子有
的溶液混合会产生无色无味气体。组成它们的离子有
| 阳离子 |
Na+、Mg2+、Al3+、Ba2+ |
| 阴离子 |
OH-、Cl-、CO32-、SO42-、HSO4- |
分别取它们的水溶液进行实验,结果如下:
①A溶液与B溶液反应生成白色沉淀,沉淀可溶于E溶液
②A溶液与C溶液反应生成白色沉淀,沉淀可溶于E溶液
③A溶液与D溶液反应生成白色沉淀,沉淀可溶于盐酸
④B溶液与适量D溶液反应生成白色沉淀,加入过量D溶液,沉淀量减少,但不消失。
据此推断它们分别是(写化学式)
A;B;C;D;E。
室温下,单质A、B、C分别为固体、黄绿色气体、无色气体,在适合的反应条件下,它们可以按照下面框图进行反应。又知E是无色溶液,请回答: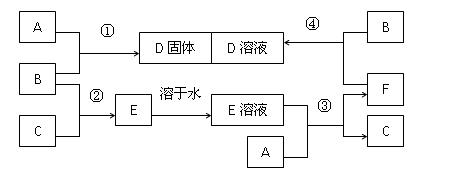
(1)B溶于水的离子方程式 。
。
(2)反应④的离子方程式为。
(3)向F的溶液中加入烧碱溶液后在空气中静置,可观察到的现象有。
将O2、NO、NH3、HCl分别 收集于等体积的四个容器中,用导管把四个容器连成整体,若使各种气体混合均匀(前后条件相同),混合前后容器内压强之比约为。(不考虑N2O4的存在)
收集于等体积的四个容器中,用导管把四个容器连成整体,若使各种气体混合均匀(前后条件相同),混合前后容器内压强之比约为。(不考虑N2O4的存在)