结合下表回答下列问题(均为常温下的数据):
| 酸 |
电离常数(Ka) |
酸 |
电离常数(Ka) |
| CH3COOH |
1.8×10-5 |
H2CO3 |
K1=4.4×10-7 K2=4.7×10-11 |
| HClO |
3×10-8 |
(1)上述三种酸中,酸性最强的是 。
(2)在常温下,相同物质的量浓度的①CH3COONa、 ②Na2CO3、③NaClO三种溶液的pH由小到大的顺序为 。(用序号回答)
(3)设计一个现象明显、操作简便的实验方案证明CH3COOH酸性强于碳酸(不用叙述仪器和具体操作) 。
(4)向Na2CO3溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的钠盐,同时还有另两种钠盐生成,该反应的化学方程式为 。
(5)实验证明:向0.01 mol/L NaAlO2溶液中加入等体积0.01 mol/L NaHCO3溶液,会产生白色胶状沉淀。据此推断CO32-和AlO2-两种离子中,结合质子(H+)能力较强的是 。
已知某溶液中只存在OH-.H+.NH4+.Cl-四种离子,某同学推测其离子浓度大小顺序有以下几种,请回答后面问题:
①c(Cl-)>c(NH4+)>c(H+)>c(OH-)②c(Cl-)>c(NH4+)>c(OH-)>c(H+)
③c(NH4+)>c(Cl-)>c(OH-)>c(H+)④c(Cl-)>c(H+)>c(NH4+)>c(OH-)
(1)上述关系一定不正确的是(填序号)
(2)若溶液中只有一种溶质,则该溶质为,该溶液中离子浓度的大小关系为(填序号)
(3)若关系③正确,则溶液中溶质为。
(4)若四种离子浓度关系有c(NH4+)=c(Cl-),则该溶液显(填“酸性”、“碱性”、“中性”)。
(5)25℃,pH="a" 的盐酸VamL与pH=14-a的氨水VbmL混合,若溶液显中性,则VaVb(填>、<、=、无法确定)
化合物F是合成治疗心血管病的重要药物——美多心安的中间体。其中一种合成路线如下:
回答下列问题:
(1)A的化学名称为。 (2) B生成C的反应类型为。
(3)由C生成D的化学方程式为:。(4)E的分子式为。
(5)F的结构简式为。1mol F与足量金属钠反应产生的气体在标准状况下的体积为。
(6)B有多种同分异构体,写出同时满足下列条件的B的所有同分异构体的结构简式。
①既能发生银镜反应,又能发生水解反应。
②核磁共振氢谱图中4组吸收峰、且峰面积之比为1:2:6:3。
开发新型储氢材料是氢能利用的重要研究方向。
(1)化合物A(H3BNH3)是一种潜在的储氢材料,可由六元环状物质(HB=NH)3通过如下反应制得:3CH4+2(HB=NH)3+6H2O=3CO2+6H3BNH3。请回答:
①H3BNH3中是否存在配位键(填“是”或“否”),B、C、N、O第一电离能由大到小的顺序为,CH4、H2O、CO2三分子按照键角由大到小的顺序排列为。
②与(HB=NH)3互为等电子体的分子为(填分子式)
③人工可以合成硼的一系列氢化物,其物理性质与烷烃相似,故称之为硼烷。工业上可采用LiAlH4和BCl3在一定条件下制备乙硼烷B2H6,该反应的化学方程式为。
④在硼酸盐中,阴离子有链状、环状、骨架状等多种结构形式。图a为一种无限长链状结构的多硼酸根,其化学式为,图b为硼砂晶体中阴离子,其中硼原子采取的杂化方式为。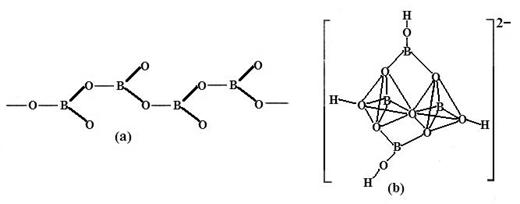
(2)一种铜合金具有储氢功能
①Cu2+的价层电子排布式为。
②铜及其它许多金属及其化合物都可以发生焰色反应,其原因是。
③铜的单质中按ABCABC……方式堆积,设铜原子半径为a pm,则该晶体的密度为g/cm3(阿伏伽德罗常数值为NA)
工业上设计将VOSO4中的K2SO4、SiO2杂质除去并回收得到V2O5的流程如下: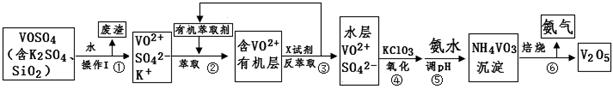
请回答下列问题:
(1)步骤①所得废渣的成分是(写化学式),操作I的名称。
(2)步骤②、③的变化过程可简化为(下式R表示VO2+,HA表示有机萃取剂):
R2(SO4)n (水层)+ 2nHA(有机层)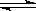 2RAn(有机层) + nH2SO4 (水层)
2RAn(有机层) + nH2SO4 (水层)
②中萃取时必须加入适量碱,其原因是。
③中X试剂为 。
(3)④的离子方程式为。
(4)25℃时,取样进行试验分析,得到钒沉淀率和溶液pH之间关系如下表:
| pH |
1.3 |
1.4 |
1.5 |
1.6 |
1.7 |
1.8 |
1.9 |
2.0 |
2.1 |
| 钒沉淀率% |
88.1 |
94.8 |
96.5 |
98.0 |
98.8 |
98.8 |
96.4 |
93.1 |
89.3 |
结合上表,在实际生产中,⑤中加入氨水,调节溶液的最佳pH为;若钒沉淀率为93.1%时不产生Fe(OH)3沉淀,则溶液中c(Fe3+)<。〖已知:25℃时,Ksp[Fe(OH)3]=2.6×10-39〗
(5)该工艺流程中,可以循环利用的物质有和。
(13分)平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵: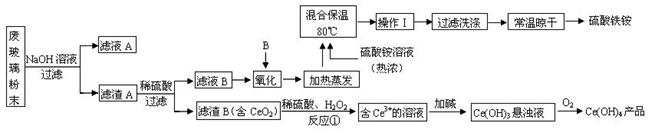
已知:
ⅰ.酸性条件下,铈在水溶液中有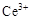 、
、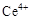 两种主要存在形式,
两种主要存在形式,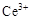 易水解,
易水解,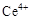 有较强氧化性。
有较强氧化性。
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于水的净化处理。
(1).操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是: 。
(2).反应①之前先要洗涤滤渣B,其目的是为了除去 (填离子符号)。
(3).写出反应①的化学方程式 。
(4).用滴定法测定制得的Ce(OH)4产品纯度。
滴定时所用定量仪器的读数精确为 ;若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5).称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。