(13分)平板电视显示屏生产过程中产生大量的废玻璃粉末(含SiO2、Fe2O3、CeO2、FeO等物质)。某课题以此粉末为原料,设计如下工艺流程对资源进行回收,得到Ce(OH)4和硫酸铁铵: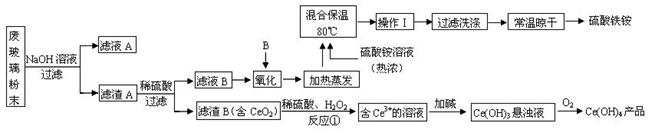
已知:
ⅰ.酸性条件下,铈在水溶液中有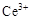 、
、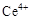 两种主要存在形式,
两种主要存在形式, 易水解,
易水解,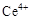 有较强氧化性。
有较强氧化性。
ⅱ.CeO2不溶于稀硫酸
ⅲ.硫酸铁铵[aFe2(SO4) 3·b(NH4) 2SO4·cH2O]广泛用于水的净化处理。
(1).操作Ⅰ的名称是 ,检验硫酸铁铵溶液中含有NH4+的方法是: 。
(2).反应①之前先要洗涤滤渣B,其目的是为了除去 (填离子符号)。
(3).写出反应①的化学方程式 。
(4).用滴定法测定制得的Ce(OH)4产品纯度。
滴定时所用定量仪器的读数精确为 ;若所用FeSO4溶液在空气中露置一段时间后再进进行滴定,则测得该Ce(OH)4产品的质量分数 。(填“偏大”、“偏小”或“无影响”)
(5).称取14.00g硫酸铁铵样品,将其溶于水配制成100mL溶液,分成两等份,向其中一份加入足量NaOH溶液,过滤洗涤沉淀并烘干灼烧至恒重得到1.60g固体;向另一份溶液中加入0.5mol/L Ba(NO3)2溶液100mL,恰好完全反应。则该硫酸铁铵的化学式为 。
(1)下表为烯类化合物与溴发生加成反应的相对速率(以乙烯为标准)。
| 烯类化合物 |
相对速率 |
| (CH3)2C=CH CH3 |
10.4 |
| CH3CH=CH2 |
2.03 |
| CH2=CH2 |
1.00 |
| CH2=CHBr |
0.04 |
根据表中数据,总结烯类化合物与溴发生加成时,反应速率与C=C上取代基的种类、个数之间的关系:。
(2)下列化合物与氯化氢加成时,取代基对反应速率的影响与上述规律类似,其中反应速率最小的是,反应速率最大的是。
A.(CH3)2C=C( CH3)2 B. CH3CH=CH CH3
C. CH2=CH2 D. CH2=CHCl
(3)今有A、B、C 3种二甲苯,将它们分别进行一硝化反应,得到的产物分子式都是C8H9NO2。A只得到一种产物,B得到两种产物,C得到三种产物。由此可以推断判断A、B、C的结构简式分别是、、。
1mol有机物能与1mol氢气发生加成反应,产物是2,2,3-三甲基戊烷,此有机物的结构简式可能有。
乙烯燃烧的化学方程式是______________________,乙烯燃烧火焰比甲烷燃烧的火焰要明亮的原因是________________________________。
某烃A、B的分子式均为C6H10,它们的分子结构中无支链或侧链。
(1)A为环状化合物,它能与Br2发生加成反应,A的名称是________。
某烯烃1 mol与H2加成后产物为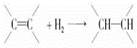 ,则原烯烃可能的结构简式为________________________。
,则原烯烃可能的结构简式为________________________。