铬及其化合物在生产生活中有很多的应用。
(1)有的铁制品如水龙头镀铬:一可以耐磨,这是利用铬的硬度大,硬度属于________性质(填物理或化学);二可以耐锈蚀,则铁制品镀铬、表面刷漆都能防止锈蚀的共同原理是 。
(2)酒精检测仪中使用了CrO3,CrO3中Cr的化合价为________,其检测原理为:
C2H5OH + 4CrO3 + 6H2SO4 = 2Cr2(SO4)3 + 2X↑+ 9H2O
则物质X的化学式为________。
(3)铬是一种重要的金属材料。某同学把表面用砂纸打磨过的铬片放入稀盐酸中,观察到铬片表面有气泡缓慢产生,该反应的化学方程式为: (注:常温下反应,铬显+3价)。由此可判断:Cr______(填“能”或“不能”)跟硝酸银溶液反应。
固体A的化学式为NH5,它的所有原子的最外层都符合相应的稀有气体原子电子层结构,该物质适当加热就分解成两种气体,试完成:
(1)固体A属于__________晶体,它的电子式为__________。
(2)A溶于水后溶液呈__________性(填“酸”“碱”或“中”),其原因是(用化学方程式表示)______________________________。
(3)A与铜或铜的某些化合物在一定条件下可合成CuH,CuH是一种难溶物,它能在氯气中着火,还能与盐酸反应放出气体,请写出这两种反应的化学方程式___________________。
用KClO3和浓盐制取消毒剂二氧化氯的方程式如下:
KClO3+HCl → KCl+ClO2↑+Cl2↑+( )
(1) 请完成该化学方程式并配平(未知物填入括号内,系数填入横线上)
(2) 浓盐酸在反应中显示出来的性质是(填编号)_______。
①只有还原性②还原性和酸性③只有氧化性④氧化性和酸性
(3) 产生0.1molCl2,则转移的电子的物质的是为_________mol.
物质分离提纯常用方法有:
| A.萃取 | B.分液 | C.过滤 | D.结晶 |
E.蒸馏 F.盐析 G.渗析。
请为下列各组混合物的分离或提纯选择最佳方法(选填标号)
(1)提纯含少量NaCl杂质的KNO3(2)除去Fe(OH)3胶体中的少量KCl
(3)分离柴油和水的混合物(4)用工业酒精制取无水乙醇
钠及其化合物具有广泛的用途。
(1)常温下,浓度均为0.1mol·L-1的下列五种钠盐溶液的pH如下表;
| 溶质 |
CH3COONa |
NaHCO3 |
Na2CO3 |
NaClO |
NaCN |
| pH |
8.8 |
9.7 |
11.6 |
10.3 |
11.1 |
上述盐溶液中的阴离子,结合H+能力最强的是_________,根据表中数据,浓度均为0.01mol·L—1的下列四种酸的溶液分别稀释100倍,pH变化最大的是________(填编号)。
A. HCN B. HClO C. CH3COOH D. H2CO3
(2)实验室中常用NaOH来进行洗气和提纯。
①当300mL 1mol·L-1的NaOH溶液吸收标准状况下4.48LCO2时,所得溶液中各离子浓度由大到小的顺序为________________。
②几种离子开始沉淀时的pH如下表:
| 离子 |
Fe2+ |
Cu2+ |
Mg2+ |
| pH |
7.6 |
5.2 |
10.4 |
当向含相同浓度Cu2+、Mg2+、Fe2+离子的溶液中滴加NaOH溶液时,_______(填离子符号)先沉淀,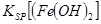 _________
_________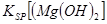 (填“>”、“=”或“<”)。
(填“>”、“=”或“<”)。
(14分) 现有25 ℃时0.1 mol/L的氨水。请回答以下问题:
(1)若向氨水中加入少量硫酸铵固体,此时溶液中 c(OH-) / c(NH3·H2O) ______(填“增大”“减小”或“不变”);
(2)若向氨水中加入稀硫酸,使其恰好中和,写出反应的离子方程式:
_____________________________________________________________________;
所得溶液的pH________7(填“>”“<”或“=”),用离子方程式表示其原因:
_________________。
(3)若向氨水中加入稀硫酸至溶液的pH=7,此时c(NH4+)=a mol/L,则c(SO42-)=________;
(4)若向氨水中加入pH=1的硫酸,且氨水与硫酸的体积比为1∶1,则所得溶液中各离子物质的量浓度由大到小的关系是______________________________________。