四种短周期元素W、X、Y、Z,原子序数依次增大,请结合表中信息回答下列问题。
| |
W |
X |
Y |
Z |
| 结构 或性质 |
最高价氧化物对应的水 化物与其气态氢化物反 应得到离子化合物 |
焰色反应呈黄色 |
在同周期主族元素形成的简单离子中,离子半径最小 |
最高正价与最 低负价之和为6 |
(1)W元素和氢可形成离子化合物,其电子式为 。
(2)Y元素和Z元素可形成YZ3化合物,可用于净水剂,净水原理 (用离子方程式表示)。
(3)①下列可作为比较X和Y金属性强弱的依据是 (填序号)。
a.最高价氧化物的水化物的碱性 b.相应硫酸盐水溶液的pH
c.单质与水反应的难易程度 d.单质与酸反应时失去的电子数
②由X、Y、氢、氧四种元素所组成的化合物,能与盐酸以1:4反应生成两种常见盐和水,则该化合物的化学式为 。
(4)W的一种氢化物HW3可用于有机合成,其酸性与醋酸相似。体积和浓度均相等的HW3与X的最高价氧化物对应的水化物混合,混合后溶液中离子浓度由大到小的顺序是 。
(10分)物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡,它们都可看作化学平衡。请根据所学知识回答:
(1)A为0.1 mol·L-1的(NH4)2SO4溶液,在该溶液中各种离子的浓度由大到小顺序为________。
(2)B为0.1 mol·L-1NaHCO3溶液,实验测得NaHCO3溶液的pH>7,请分析NaHCO3溶液显碱性的原因:________________________________________。
(3)C为FeCl3溶液,实验室中配制FeCl3溶液时通常需要向其中加入________,目的是_______________;
若把B和C溶液混合,将产生红褐色沉淀和无色气体,该反应的离子方程式为__________________。
有A、B、C、D四种短周期元素, 它们的原子序数由A到D依次增大,已知A和C原子最外层只有一个电子,C燃烧时的焰色反应是黄色,C的单质在高温下与B的单质充分反应可以产生淡黄色固态化合物,A单质与D单质可以发生化合反应,且反应条件可以是点燃或者光照,试根据以上叙述回答:
(1)写出A、B、C、D的元素名称:A _______ B _______ C _______ D ______。
(2)写出化学方程式:①C+B=;
②A+D=。
C元素离子的离子结构示意图___________,D元素位于周期表中的位置__________。
(1)瑞典化学家舍勒将软锰矿(主要成分MnO2)与浓盐酸混合加热,在世界上首先制得了氯气,写出该反应的离子方程式___________________________________________。洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学反应方程式为___。
(2)在3Cu + 8HNO3= 3Cu(NO3)2 + 2NO↑+ 4H2O反应中。
①每生成2mol的NO,反应过程中转移电子的个数为个。
②当有19.2g Cu参加反应时,消耗硝酸的总量为_____mol,被还原的硝酸为_____mol。
③当生成标况下的NO 22.4L时,被还原的硝酸是_____mol。
(1)纯净物根据其组成和性质可进行如下分类: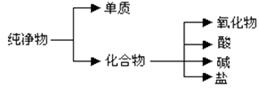
上图所示的分类方法属于(填序号)
A.交叉分类法B.树状分类法
下列2组物质中均有一种物质的类别与其它2种不同
A.CaO、Na2O、SiO2B.Al(OH)3、KOH、Ba(OH)2
以上两组物质中,每组里与别的两物质的类别明显不同的物质依次是(填化学式);。
写出能用离子方程式CO32- + 2H+="=" CO2↑+H2O表示的一个化学反应方程式:。
(2)下图为实验室制取氨的实验装置。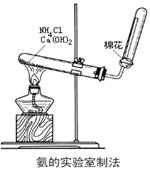
①写出A中所发生反应的化学方程式。
②该装置还可以制备哪些气体________。
③在收集氨时试管口棉花团的作用是。
④收集氨气应使用___法,要得到干燥的氨气可选用___作干燥剂,检验集满的方法是。
(10分)氢能源是一种重要的清洁能源。现有两种可产生H2的化合物甲和乙。将6.00 g甲加热至完全分解,只得到一种地壳中含量最多的金属单质和6.72 L的H2(已折算成标准状况)。甲与水反应也能放出H2,同时还产生一种白色沉淀物,该白色沉淀可溶于NaOH溶液。化合物乙在催化剂存在下可分解得到H2和另一种单质气体丙,丙在标准状况下的密度为1.25 g·L-1。请回答下列问题:
(1)甲的化学式是____________。
(2)甲与水反应的化学方程式是_______________________。
(3)气体丙与金属镁反应的产物是________(用化学式表示)。
(4)乙在加热条件下与CuO反应可生成Cu和气体丙,写出该反应的化学方程式______________。
(5)有人提出产物Cu中可能还混有Cu2O,请设计实验方案验证之__________________________。(已知:Cu2O+2H+=Cu+Cu2++H2O)