(1)写出表示含有8个质子、10个中子、10个电子的离子的符号 。
(2)周期表中位于第8纵行的铁元素属于第 族。
(3)周期表中最活泼的非金属元素位于第 纵行 族。
(4)试将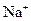 、
、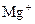 、
、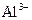 、
、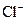 、
、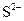 等五种离子按半径由大到小的顺序排列(用离子符号表示)____________________。
等五种离子按半径由大到小的顺序排列(用离子符号表示)____________________。
在一定温度下,向一2L固定容积的密闭容器中通入20 molN2和60 molH2,经过5分钟后,N2的浓度是5mol∕L,又过了5分钟 N2、H2、NH3的浓度不再变化,此时NH3的浓度是14 mol∕L,达到平衡后共放出QKJ的热量,试完成下列问题:
⑴前5分钟用H2表示的化学反应速率();
⑵反应达到平衡后N2的转化率();
⑶表示该温度下合成氨的化学平衡常数的表达式为();
⑷若平衡后再增大压强,化学平衡向()方向移动(填“正”“逆”“不”);
⑸该温度下反应的热化学方和式为()(用含Q的式子表示);
⑹在该温度下,向另一2L固定容积的密闭容器中通入N2 5 mol、H215 mol、NH330 mol,反应达到平衡后H2的浓度是()。
按要求完成下列问题。
⑴.写出铅蓄电池放电时的总反应和两个电极反应及反应类型
放电总反应:
负极:()反应;
正极:()反应;
⑵.写出氯碱工业中电解饱和食盐水的总反应和两个电极反应及反应类型
电解总反应:
阳极:()反应;
阴极:()反应;
⑶.氢氧燃料电池中用KOH做电解质溶液,H2是还原剂,O2是助燃剂,写出正、负两极的电极反应
负极:正极:
下图转化关系中A—H为中学化学常见化合物,甲、乙、丙、丁为常见单质,其中甲、丁常温为气体。已知单质乙、化合物A为黄色(或淡黄色)固体。乙经过连续与甲反应后,再与水化合,是工业上制H的反应过程。B、F两种气体都能使澄清石灰水变浑浊。(部分反应物或产物略去)
(1)写出下列物质的化学式:A________ F________ 甲_______ 丙________ .
(2)按要求完成下列反应:
A与B反应的化学方程式 ____________________________________;
丙与D溶液反应的离子方程式_________________________________。
(3)鉴别B和F的方法_____________________________________________。
某化学兴趣小组在课外活动中,对某溶液进行了三次检验,每次检验结果如下表所示,请回答下列问题。
| 检验次数 |
溶液中检验出的物质 |
| 第一次 |
KCl、K2SO4、Na2CO3、NH4Cl |
| 第二次 |
BaCl2、Na2SO4、K2CO3、NH4Cl |
| 第三次 |
NaCl、Na2SO4、K2CO3、NH4Cl |
(1)三次检验结果中第次检验结果不正确。
(2)检验时,为了证明溶液中存在SO42-、Cl-、CO32-,取一份溶液,进行下列实验:
第一步:向溶液中滴加过量的(填化学式)溶液,其目的是;
第二步:向溶液中滴加过量的(填化学式)溶液,其目的是;
第三步:过滤,再向滤液中加入少量的(填化学式)溶液,其目的是;
(3)为了确定 NH4+的存在,写出鉴定NH4+的实验方法和现象:。
已知:将SO2通入FeCl3溶液中,溶液颜色会变为浅绿色,其原理可表示为:
□Fe3++□SO2+□H2O —— □Fe2++□SO42-+□H+
(1)请配平上述离子方程式;
(2)若参加反应的SO2在标准状况下的体积为1.12 L,则该反应转移的电子的物质的量为_______mol;
(3)已知向Fe2+溶液中滴加少量硝酸时,溶液由浅绿色变为黄色。则Fe3+、SO42-、HNO3的氧化性强弱顺序为____________。