聚硅硫酸铁(PFSS)是新型无机高分子混凝剂,广泛应用于水的净化处理。PFSS化学组成可表示为:[Fe2(OH)n(SO4)3-n/2(SiO2)x]m,由钢渣合成PFSS主要工艺流程如下:
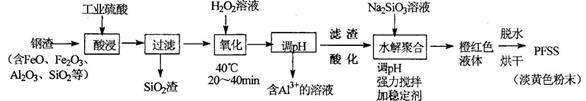
(1)酸浸时,采用100~140℃和2~3h,其目的是 。
(2)氧化时,需将溶液冷却到40℃以下,其目的是 。
(3)除Al3+时,先调节pH值到 。(参见表),得Fe(OH)3沉淀,过滤除去滤液,再用硫酸溶解Fe(OH)3得硫酸铁溶液。
| |
开始沉淀 pH |
沉淀完全 pH |
| Al3+ |
3.5 |
4.7 |
| Fe3+ |
1.9 |
3.2 |
(4)Na2SiO3溶液可由SiO2渣除杂后与35%的NaOH溶液反应制备,该反应的离子方程式为 。
(5)水解聚合时,强力搅拌的目的是 ;检验透明橙红色液体中,其分散质直径在l~l00nm的简单方法是 。
氯气是重要的化工原料。
(1)氯气溶于水得到氯水,氯水中存在下列反应:Cl2 + H2O H++Cl-+ HClO,其平衡常数表达式为K= 。
H++Cl-+ HClO,其平衡常数表达式为K= 。
(2)工业上常用熟石灰和氯气反应制取漂白粉,化学反应方程式是。流程如下图所示,其主要设备是氯化塔,塔从上到下分四层。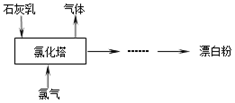
将含有3%~6%水分的熟石灰从塔顶喷洒而入,氯气从塔的最底层通入。这样加料的目的是。处理从氯化塔中逸出气体的试剂为。
(3)某科研小组在实验室用较浓的KOH溶液直接吸收氯气,研究发现反应进行一段时间后开始出现KClO3并逐渐增多,产生KClO3的离子方程式是,其原因可能是,
污染物的有效去除和资源的充分利用是化学造福人类的重要研究课题。某研究小组利用软锰矿(主要成分为MnO2,另含有少量铁、铝、铜、镍等金属化合物)作脱硫剂,通过如下流程既脱除燃煤尾气中的SO2,又制得电池材料MnO2(反应条件已省略)。
请回答下列问题:
(1)上述流程脱硫实现了(选填下列字母编号)。
A.废弃物的综合利用B.白色污染的减少 C.酸雨的减少
(2)过滤操作用到的玻璃仪器有:。
(3)用MnCO3能除去溶液中Al3+和Fe3+,其原因是。
(4)写出KMnO4溶液加入到MnSO4溶液中制备MnO2的离子反应方程式:;用惰性电极电解MnSO4溶液也可制得MnO2,其阳极的电极反应式是。
(5)MnO2是碱性锌锰电池的电极材料,电池反应方程式为:2MnO2+Zn+H2O====2MnOOH+Zn(OH)2,写出该电池放电时,正极的电极反应式是。
为了减少煤燃烧对大气造成的污染,煤的气化和液化是高效、清洁利用煤炭的重要途径,而减少CO2气体的排放也是人类面临的重大课题.煤综合利用的一种途径如下所示:
(1)用下图所示装置定量检测过程①产生的CO2(已知:煤粉燃烧过程中会产生SO2),B中预 期的实验现象是。
(2)已知:C(s)+H2O(g)====CO(g)+H2(g) △H1=+131.3kJ•mol-1
C(s)+2H2O(g)====CO2(g)+2H2(g) △H2=+90kJ•mol-1
则一氧化碳与水蒸气反应生成二氧化碳和氢气的热化学方程式是。
(3)将燃煤废气中的CO2转化为二甲醚的反应原理为:
2CO2(g)+6H2(g)  CH3OCH3(g)+3H2O(g);ΔH
CH3OCH3(g)+3H2O(g);ΔH
①该反应平衡常数表达式为K=。
②已知在某压强下,该反应在不同温度、不同投料比时,CO2的转化率如右图所示。该反应的ΔH________(填
“>”、“<”或“=”)0。若温度不变,减小反应投料比[n(H2) /n(CO2)],则K将________(填“增大”、“减小”或“不变”)。
(4)合成气CO和H2在一定条件下能发生如下反应:CO(g) +2H2(g) CH3OH(g)△H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是。
CH3OH(g)△H<0。在容积均为VL的I、Ⅱ、Ⅲ三个相同密闭容器中分别充入amol CO和2a mol H2,三个容器的反应温度分别为T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到t min时CO的体积分数如图所示,此时I、Ⅱ、Ⅲ三个容器中一定达到化学平衡状态的是;若三个容器内的反应都达到化学平衡时,CO转化率最大的反应温度是。
氯酸镁[Mg(ClO3)2]常用作催熟剂、除草剂等,实验室制备少量Mg(ClO3)2•6H2O的流程如下:
已知:
①卤块主要成分为MgCl2•6H2O,含有MgSO4、FeCl2等杂质。
②四种化合物的溶解度(S)随温度(T)变化曲线如图所示。
(1)“调节pH=4”可选用的试剂是(填编号)。
①MgO②CuO ③MgCO3④Mg
(2)加入BaCl2的目的是除去杂质离子,检验杂质离子已沉淀完全的方法是。
(3)“滤渣”的主要成分为。
(4)加入NaClO3饱和溶液发生反应为:MgCl2+2NaClO3═===Mg(ClO3)2+2NaCl,再进一步制取Mg(ClO3)2•6H2O的实验步骤依次为:①蒸发、浓缩、结晶;②;③;④过滤、洗涤、干燥。
(5)将产品先用水洗涤,再用无水乙醇清洗。无水乙醇的作用是。
(6)产品中Mg(ClO3)2•6H2O含量的测定:
步骤1:准确称量3.00g产品配成100mL溶液。
步骤2:取10mL于锥形瓶中,加入10mL稀硫酸和20mL 1.000mol•L-1的FeSO4溶液,微热。
步骤3:冷却至室温,用0.100mol•L-1 K2Cr2O7溶液滴定至终点,此过程中反应的离子方程式为:
Cr2O72-+6Fe2++14H+===2Cr3++6Fe3++7H2O。
步骤4:将步骤2、3重复两次,平均消耗K2Cr2O7溶液15.00mL。
①写出步骤2中发生反应的离子方程式:。
②产品中Mg(ClO3)2•6H2O的质量分数为。
酸浸法制取硫酸铜的流程示意图如下
(1)步骤①中Cu2(OH)2CO3发生反应的化学方程式为。
(2)在步骤③发生的反应中,1mol MnO2转移2mol 电子,该反应的离子方程式为。
(3)该小组为测定黄铵铁矾的组成,进行了如下实验:
a.称取4.800 g样品,加盐酸完全溶解后,配成100.00 mL溶液A;
b.量取25.00 mL溶液A,加入足量的KI,用0.2500 mol·L-1Na2S2O3溶液进行滴定(反应方程式为I2+2Na2S2O3=2NaI+Na2S4O6),消耗30.00 mLNa2S2O3溶液至终点。
b.量取25.00 mL溶液A,加入足量的NaOH溶液充分反应后,过滤、洗涤、灼烧得红色粉末0.600g。
c.另取25.00 mL溶液A,加足量BaCl2溶液充分反应后,过滤、洗涤、干燥得沉淀1.165 g。
①用Na2S2O3溶液进行滴定时,滴定到终点的颜色变化为。
②通过计算确定黄铵铁矾的化学式(写出计算过程)。