现有以下物质:①Al;②稀硫酸;③NaHCO3;④液氨;⑤盐酸;⑥蔗糖溶液;⑦无水乙醇;⑧熔融NaOH;⑨NaHSO4;⑩CO2,回答下列问题(用相应物质的序号填写)
(1)可以导电的有 ;
(2)属于非电解质的有 ;
(3)请写出③的电离方程式 ;
(4)写出⑧中的物质的溶液与⑨的溶液反应的离子方程式 ;
(5)写出①与⑧中的物质的溶液反应的离子方程式 。
如图所示,容器A左侧是无摩擦、可平行移动的活塞。向A中充入1molX和1molY,向B中充入2molX和2molY,起始时V(A)=V(B)=aL。在相同温度和有催化剂存在的条件下,两容器各自发生:X(g)+Y(g)  Z(g)+2W(g),△H<0。达到平衡时V(A)=1.2aL。试回答:
Z(g)+2W(g),△H<0。达到平衡时V(A)=1.2aL。试回答: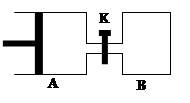
(1)A中X的转化率为。
(2)平衡时,A、B中X转化率大小关系为AB(选填“>”、“<”、“="”" )
一定条件下,某容积为1L的密闭容器中发生如下反应:
C(s)+H2O(g) CO(g)+H2 (g)
CO(g)+H2 (g)
(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均相对分子质量为Mr,则Mr的范围为 。
(2)达到平衡后,保持容器容积不变,向体系中再加入一定质量的C,逆反应速率 (填“增大”、 “减小”或“不变”),化学平衡(填“正移”、 “逆移”或“不变”);若保持温度不变,压缩容积,逆反应速率 ,化学平衡。
已知下列热化学方程式:
①H2(g)+ O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
O2(g)=H2O(l) ΔH=-285.8 kJ·mol-1
②H2(g)+ O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
O2(g)=H2O(g) ΔH=-241.8 kJ·mol-1
③C(s)+ O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
O2(g)=CO(g) ΔH=-110.5 kJ·mol-1
④C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1,
回答下列问题:
(1)上述反应中属于放热反应的是____________。
(2)H2的燃烧热为____________;C的燃烧热为____________。
(3)燃烧10 g H2生成液态水,放出的热量为____________。
(4)写出CO燃烧的热化学方程式__________________________________。
铝土矿的主要成分是 ,含有杂质
,含有杂质 、
、 、
、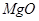 。工业上从铝土矿中提取铝可采用如下工艺流程:
。工业上从铝土矿中提取铝可采用如下工艺流程:
请回答下列问题:(1)图中涉及分离溶液与沉淀的实验方法是_________(填操作名称)。
(2)沉淀B的成分是____________(填化学式,下同),沉淀C的成分是____________;溶液D中所含的酸根离子是。
(3)沉淀F转化为物质M的化学方程式为________________________;
溶液D中通入过量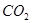 生成沉淀F的离子方程式为_______________________。
生成沉淀F的离子方程式为_______________________。
(4)能否将向溶液D中通入过量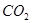 换成加入过量盐酸?(填 能 或 不能)
换成加入过量盐酸?(填 能 或 不能)
其理由是
甲、乙、丙三种物质之间有如下图所示的转化关系,其中甲物质为氧化物:
(1)若甲是不溶于水的白色固体,但既能溶于硫酸又能溶于氢氧化钠溶液,写出下列转化的方程式:
乙 丙的离子方程式_____________________________;
丙的离子方程式_____________________________;
丙 甲的化学方程式______________________________。
甲的化学方程式______________________________。
(2)若向乙溶液中加入KSCN溶液,混合溶液呈红色,则甲物质是________(填化学式)。甲 乙的离子方程式是______________________________。
乙的离子方程式是______________________________。