一定条件下,某容积为1L的密闭容器中发生如下反应:
C(s)+H2O(g) CO(g)+H2 (g)
CO(g)+H2 (g)
(1)维持温度不变,向该容器中充入2 mol C(s)和2 mol H2O(g),达到平衡后混合气体的平均相对分子质量为Mr,则Mr的范围为 。
(2)达到平衡后,保持容器容积不变,向体系中再加入一定质量的C,逆反应速率 (填“增大”、 “减小”或“不变”),化学平衡 (填“正移”、 “逆移”或“不变”);若保持温度不变,压缩容积,逆反应速率 ,化学平衡 。
氮可以形成多种离子,如N3-,NH2-,N3-,NH4+,N2H5+,N2H62+等,已知N2H5+与N2H62+是由中性分子结合质子形成的,类似于NH4+,因此有类似于 NH4+的性质。
(1)NH4+的电子式为,N采用杂化方式,NH4+粒子空间构型为,键角为。
(2)写出二种由多个原子组成的含有与N3-价电子数相同的物质的化学式。
(3)等电子体的微粒往往具有相似的结构,试预测N3-的构型。
请根据表格回答问题:
(ⅰ)根据下列五种元素的电离能数据(单位:kJ/mol),回答下面各题。
| 元素代号 |
I1 |
I2 |
I3 |
I4 |
| E |
500 |
4600 |
6900 |
9500 |
| F |
740 |
1500 |
7700 |
10500 |
| H |
580 |
1800 |
2700 |
11600 |
| I |
420 |
3100 |
4400 |
5900 |
(1)在周期表中,最可能处于同一族的是()
A.F和H B.H和I C.E和H D.E和I
(2)它们的氯化物的化学式,最可能正确的是()
A.ECl B.FCl3 C.HCl D.ICl4
(3)F元素最可能是()
A.S区元素 B.稀有气体元素 C.p区元素D.准金属 E.d区元素
(ⅱ)右表是元素周期表的一部分: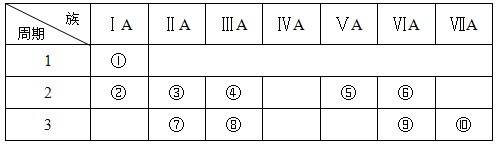
(4)某元素原子的核外p电子数比s电子数少1,则该元素的元素符号是
其原子的结构示意图是。
(5)已知某些不同族元素的性质也有一定的相似性,如元素③与元素⑧的氢氧化物有相似的性质。这种现象被称为。
(6)又如表中与元素⑦的性质相似的不同族元素是(填元素符号)。
已知元素的某种性质“X”和原子半径、金属性、非金属性等一样,也是元素的一种基本性质。下面给出13种元素的X的数值:
| 元素 |
Al |
B |
Be |
C |
Cl |
F |
Li |
| X的数值 |
1.5 |
2.0 |
1.5 |
2.5 |
2.8 |
4.0 |
1.0 |
| 元素 |
Mg |
Na |
O |
P |
S |
Si |
|
| X的数值 |
1.2 |
0.9 |
3.5 |
2.1 |
2.5 |
1.7 |
试结合元素周期律知识完成下列问题:
(1)经验规律告诉我们:当形成化学键的两原子相应元素的X差值大于1.7时,所形成的一般为离子键;当小于1.7时,一般为共价键。试推断BeCl2中的化学键类型是。
(2)根据上表给出的数据,简述主族元素的X的数值大小与元素的金属性之间的关系;简述第二周期元素(除惰性气体外)的X的数值大小与原子半径之间的关系。
(3)某化合物分子中含有S—N键,你认为该共用电子对偏向于原子(填元素符号)。
(4)写出O原子的电子排布图
(5)Cl元素的最高正价为,其最高价氧化物的水化物的化学式为。
(6)若要鉴定某化合物中是否含有S元素,需用的方法;若要确定C2H6O的结构,需用的方法,分子式为C2H6O的两种不同的结构简式分别为,,这两种结构互为。
根据所学物质结构知识,请你回答下列问题:
(1)人们把电子云轮廓图称为原子轨道,S电子的原子轨道都是形的,P电子的原子轨道都是形的。
(2)原子序数为24的元素原子中有个能层,个能级,个未成对电子。
(3)硅原子核外电子排布式为,价电子排布式为
(4)NCl3常温下为黄色粘稠的油状液体,可用作引爆剂和化学试剂。NCl3分子的VSEPR模型是,立体构型是,中心原子采取杂化方式。
(5)具有(n-1)d10ns2电子构型的元素位于周期表中区和族。
(14分)已知元素周期表中共有18纵行,如图实线表示元素周期表的边界,按电子排布,可把周期表划分为s区、p区、d区、ds区等。除ds区外,其他区的名称均按构造原理最后填入电子的能级符号来命名。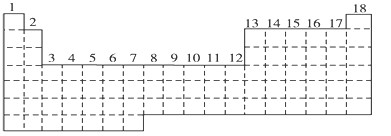
(1)请在图中用实线画出s区、p区、d区、ds区的边界线,并标记分区。
(2)有的同学受这种划分的启示,认为d区内6、7纵行的部分元素可以排在另
一区,你认为应排在________区。
(3)请在元素周期表中标出4s轨道半充满的元素(用元素符号表示)。
(4)随着科学技术的发展,不断有新的元素被发现。若把第七周期排满,则元
素周期表共可以排布________种元素。
(5)在周期表中,电负性最大的元素是,该元素的原子轨道图。
写出该单质与水反应的化学方程式:。