(14分)亚硝酸(HN02)在工业上用于有机合成,既具有氧化性又具有还原性,而且氧化性比还原性突出得多。回答下列问题:
(1)亚硝酸是一种中强酸,写出其电离方程式 。
(2)HNO2及NaN02均可将溶液中的I-氧化为I2,这个反应可用于分析测定。
①HNO2中,N元素的化合价为 。
②在酸性条件下,NaN02与KI按物质的量之比l:1恰好完全反应,含氮产物为 (填化学式)。
③要得到稳定的HN02溶液,可以往冷的浓NaN02溶液中加入或通入某种物质,下列物质中不适合使用的
是 (填序号)。
a.磷酸
b.二氧化碳
c.稀硫酸
d.二氧化硫
e.次氯酸
(3)HNO2的工业制法是:将二氧化氮和一氧化氮的混合物溶解在接近零度的水中,即生成亚硝酸的水溶液。写出该反应的化学方程式: 。
(4)亚硝酸盐对人体健康的损害不亚于农药。可采用电解法除去。电解含Ce3+、NO2- 的废水除去NO2- ,其次是再生Ce4+,其原理如图所示。
①Ce4+从电解槽的 (填字母序号)口流出。
②写出阴极的电极反应式 。
1mol分子组成为C3H8O的液态有机物A,与足量的金属钠作用,可生成11.2 L氢气(标准状况),则A分子中必有一个___基,若此基在碳链的一端,则A的结构简式为。A与浓硫酸共热,分子内脱去1分子水,生成B,反应的方程式为;B通入溴水能发生________反应,反应的方程式为。
(10分)0.2mol某烃A在氧气中完全燃烧后,生成CO2和H2O各1.2mol。试回答:
(1)烃A的分子式为________________
(2)若取一定量的该烃A完全燃烧后,生成CO2和H2O各3mol,则有______g烃A参加了反应。
(3)若烃A不能使溴水褪色,但在一定条件下能与氯气发生取代反应,其一氯取代物只有一种,则烃A的结构简式为______
(4)若烃A能使溴水褪色,在催化剂作用下,与H2加成,其加成产物经测定分子中含有4个甲基,烃A可能有的结构简式为______(任写1个)
(5)比烃A少一个碳原子且能使溴水褪色的A的同系物有______种同分异构体.
写出下列反应的化学方程式。
(1)苯与液溴发生取代反应________________
(2)制乙酸乙酯的反应________________
(3)在苯酚钠溶液中通入过量的二氧化碳气体________________
(4)苯酚溶液与溴水的反应___________________________
燃煤和汽车尾气是造成空气污染产生雾霾的原因之一。消除汽车尾气是减少城市空气污染的热点研究课题。
(1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ·mol-1
②CO(g)+1/2 O2(g)=CO2 (g)△H=-283kJ·mol-1
则汽车尾气中NO和CO在催化转化器中相互反应成无污染的气体的热化学方程式是_______________。
(2)在密闭容器中发生该反应时,c(CO2)随温度(T)、催化剂的表面积(S)和时间(t)的变化曲线,如图所示。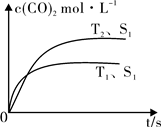
已知当固体催化剂的质量一定时,增大其表面积可提高化学反应速率。若催化剂的表面积S1>S2,在上图中画出c(CO2)在T2、S2条件下达到平衡过程中的变化曲线。
(3)在一定温度下,将2.0mol NO、2.4mol气体CO通入到固定容积为2L的容器中,反应过程中部分物质的浓度变化如图所示: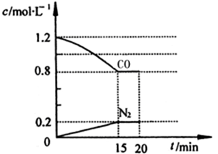
①有害气体NO的转化率为__________,0~15min NO的平均速率v(NO)=__________mol/(L·min)。(保留两位有效数字)
②20min时,若改变反应条件,导致CO浓度减小,则改变的条件可能是________(选填序号)。
a.缩小容器体积b.增加CO的量
c.降低温度d.扩大容器体积
③若保持反应体系的温度不变,20min时再向容器中充入NO、N2各0.4mol,化学平衡将______移动(选填“向左”、“向右”或“不”),移动后在达到平衡时的平衡常数的值是_______(保留两位有效数字)。
(4)汽车尾气中的SO2和过氧化氢可设计成酸性原电池,请写出它的正极反应的方程式__________。
元素X、Y、Z、W、M、N原子序数依次增大,X与M、W与N分别同主族,且元素X、Y、Z、W分属两个短周期,它们四者原子序数之和为22,最外层电子数之和为16,在化合物Y2X2、Z2X4、X2W2中,相应分子内各原子最外层电子都满足稳定结构,请回答下列问题:
(1)Y元素在周期表中的位置是__________________________,X、Y、Z、W、M的原子半径由大到小的顺序为:_______________(用元素符号表示)。
(2)写出Y2X2的电子式____________;Z2X4结构式 _______________。
(3)X、Z、W形成的化合物,水溶液一定显酸性的盐是______________,其原因是_____________(用离子方程式表示),该物质所含化学键的类型是_____________。
(4)均含X、W、M、N四种元素的两种化合物相互反应有刺激性气味气体放出,反应的离子方程式为_______________。
(5)火箭发动机曾经利用Z2X4作燃料X2W2作助燃剂,产物环保无污染,写出二者反应的方程式___________________。
(6)写出N W2通入硝酸钡溶液中的离子方程式 ______________。