(15分)甲醇是重要的化工原料,在化工生产中有广泛的应用。
(1)电子工业中使用的一氧化碳常以甲醇为原料通过脱氢反应生成H2和甲酸甲酯(HCOOCH3)、再分解生成CO和CH3OH。写出相应反应的化学方程式: 。
(2)利用太阳能或生物质能分解水制H2,然后可将H2与C02转化为甲醇。已知:
光催化制氢:2H20(1)=2H2(g)+O2(g)  H=+571.5 kJ·mol-1
H=+571.5 kJ·mol-1
H2与C02耦合反应:3H2(g)十CO2(g)=CH3OH(1)+H20(1)  H= 一137.8 kJ·mol-1
H= 一137.8 kJ·mol-1
则反应:2H2O(1)+C02(g)=CH30H(l)+3/202(g)的 H= kJ·mol-1
H= kJ·mol-1
(3)已知反应:CO(g)+2H2(g) CH3OH(g)
CH3OH(g)  H=Q
H=Q
在20 L的密闭容器中,按物质的量之比1:2充入CO和H2,测得CO的转化率随温度及压强的变化如下图所示,P2及195 ℃时n(H2)随时间的变化如表所示。

①O~3 min,平均速率V(CH3OH)= ,Q 0(填“<”“=”或“>”)。
②图中压强(P1、P2)的大小顺序为 ,理由是 。
③在P2及195 ℃时,该反应的平衡常数K= 。
在10mL含有AlO2-离子的溶液中逐滴加入1mol/L的盐酸,所得Al(OH)3沉淀质量和所加盐酸的体积关系如图所示。
问: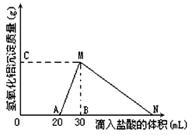
(1)此溶液中同时含有____mol___离子;
(2) C(或M)点的纵坐标为0.78,则c(AlO2-)为
(3) 点B的横坐标为30,则到点N处滴入的HCl溶液体积为mL
合成氨对农业生产及国防建设均具有重要意义。
N2(g)+3H2(g)  2NH3(g) △H =" -92" kJ·mol-1
2NH3(g) △H =" -92" kJ·mol-1
(1)在恒温恒容密闭容器中进行的合成氨反应,下列能表示达到平衡状态的是_______(填序号)。
a.混合气体的压强不再发生变化
b.混合气体的密度不再发生变化
c.反应容器中N2、NH3的物质的量的比值不再发生变化
d.单位时间内断开a个H-H键的同时形成3 a个N-H键
e.三种物质的浓度比恰好等于化学方程式中各物质的化学计量数之比
(2)在恒温恒容的密闭容器中,合成氨反应的各物质浓度变化曲线如下图所示。请回答下列问题:
① 表示N2的浓度变化的曲线是(选填曲线代号“A”、“B”或“C”)。
② 前25 min 内,用H2的浓度变化表示的化学反应平均速率是。
③在25 min 末反应刚好达到平衡,则该温度下反应的平衡常数K = (计算结果可用分数表示)。
若升高温度,该反应的平衡常数值将_______(填“增大”、“减小”或“不变”)。
(Ⅰ) “亮菌甲素”结构简式如右图,是黄色或橙黄色结晶粉末,几乎不溶于水,辅料丙二醇(C3H8O2)溶成针剂用于临床。该药为利胆解痉药,适用于急性胆囊炎、慢性胆囊炎急性发作及慢性浅表性胃炎等。
(1)写出“亮菌甲素”的分子式_________________。
(2)1mol 亮菌甲素最多能和_______mol H2发生反应,该反应类型是_______反应。
(3)1mol“亮菌甲素”最多与mol NaOH反应。
(Ⅱ)含碳、氢、氧元素的下列有机物分子式通式:
A.Cn(H2O)m B.(C2H3)n(H2O)mC.(C2H)n(H2O)m D.(CH)n(H2O)mE.(C2O)n(H2O)m F.(CO)n(H2O)m
(1)若充分燃烧某类有机物,消耗氧气的体积与生成二氧化碳的体积之比为5∶4(相同条件下),则该类有机物分子式通式是上述各式中的_________(填代号)。
(Ⅱ)(1)消耗的氧气和生成二氧化碳的体积比5:4,1个C消耗1个O2,4个C消耗4个O2,4个H消耗1个O2,所以,C:H=4:4因为需消耗5O2,产生4CO2,根据元素守恒可知,有机物中含有2个O,C:H:O=4:4:2=2:2:1,表示为(CH)n(H2O)m,故选D。
(2)若某有机物分子式符合上述C的通式,其相对分子质量为136,写出该有机物的分子式为____;若该有机物属于酯类且分子中含有苯环,则其可能的同分异构体有___种。
氮化硅(Si3N4)是一种新型陶瓷材料,它可用石英与焦炭在高温的氮气流中反应制得:SiO2+C +N2 Si3N4+CO
Si3N4+CO
根据题意完成下列各题:
(1)配平上述化学反应方程式。
(2)为了保证石英和焦炭尽可能的转化,氮气要适当过量。某次反应用了20mol氮气,反应生成了5mol一氧化碳,此时混合气体的平均相对分子质量是。
(3)分析反应可推测碳、氮气的氧化性:CN2(填“>”“<”“=”)。
H2O2是在医疗、化工方面应用广泛的化学试剂。
(1)Na2O2、CaO2以及BaO2都可与酸作用生成过氧化氢,实验室通过上述某种过氧化物与适量稀硫酸作用,过滤后即可制得较纯净的H2O2溶液,则应选择的过氧化物是________;
(2)实验室可用H2O2与次氯酸钠反应制氧气,其中还原剂是__________,写出该反应的化学方程式,生成0.5mol氧气,转移电子______mol;
(3)用酸性高锰酸钾溶液滴定法可测定双氧水中H2O2的含量:
H2O2 + KMnO4 + H2SO4 → MnSO4 + K2SO4 + O2↑ + H2O ,若滴定中消耗0.50mol/L的高锰酸钾溶液40.00mL,则此双氧水溶液中溶质的质量为____________ g。