火箭推进器中盛有强还原剂液态肼(N2H4)和强氧化剂液态双氧水。当把0.4mol液态肼和0.8mol液态 H2O2混合恰好完全反应,生成氮气和水蒸气,放出256 kJ的热量。
(1)反应的热化学方程式为 。
(2)又已知16g液态肼与液态双氧水反应生成液态水时放出的热量是408 kJ。则H2O(g)=H2O(l)
的ΔH= 。
(3)已知N2(g) + 2O2(g) ="=" 2NO2(g);△H=+67.7KJ/mol,
N2H4(g) + O2(g) ="=" N2(g)+2H2O(g);△H= —534KJ/mol,
则肼与NO2完全反应的热化学方程式为_____ _____________________。
某无色稀溶液X中,可能含有下表所列离子中的某几种。
| 阴离子 |
CO32-、SiO32-、AlO2-、Cl- |
| 阳离子 |
Al3+、Fe3+、Mg2+、NH4+、Na+ |
现取该溶液适量,向其中加入某试剂Y,产生沉淀的物质的量(n)与加入试剂体积(V)的关系图所示。(提示:铵根和偏铝酸根不能共存)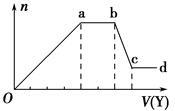
(1)若Y是盐酸,则X溶液中一定含有的离子是 ,ab段发生反应的总离子方程式为 ,图中Oa段与Y溶液反应的离子的物质的量之比为 【要标明离子符号,如n(Na+)】。
(2)若Y是NaOH溶液,则ab段反应的离子方程式为 ; bc段反应的离子方程式为______________________________。若不考虑离子的水解因素,忽略H+和OH-,且溶液中只存在4种离子,则它们的离子个数比为_________________________________【要标明离子符号,如n(Na+),按阳离子在前,阴离子在后,高价在前,低价在后的顺序排列】
(16分) Ⅰ请回答:
(1)CO2的电子式____________________
(2)钠燃烧不能用CO2灭火,用化学方程式表示其理由________________
(3)重晶石(BaSO4)不溶于酸,用饱和Na2CO3处理转化为易溶于酸的BaCO3,写出反应的离子方程式__________________
Ⅱ。化合物K3Fe(A2B4)3.3H2O 是重要的催化剂。将化合物K3Fe(A2B4)3.3H2O受热完全分解,只得到气体产物和固体产物。 经分析,气体产物只有甲、乙和水蒸气。已知甲、乙均由A、B两元素组成,且摩尔质量:M(甲)>M(乙)。A元素的最外层电子数是次外层电子数的2倍,B元素的主族序数是其所在周期数的3倍。 经分析,固体产物只有Fe、FeO和K2AB3。某同学再进行以下定量分析。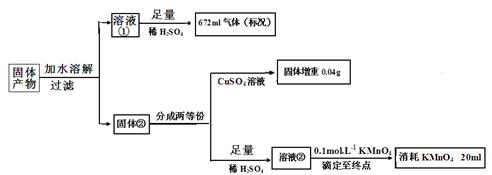
(1)甲的化学式:____________________
(2)溶液②与KMnO4发生氧化还原反应的离子方程式:_______________________
(3)由以上实验数据的分析可知n(Fe):n(FeO):n(K2AB3)= : :
(4)某同学认为:溶液②由紫红色变为无色,振荡试样半分钟内不变色,即可证明溶液②与KMnO4溶液反应达滴定终点。判断该同学设想的合理性并说明理由
氯气常用于自来水厂杀菌消毒.
(1)工业上用铁电极和石墨做为电极电解饱和食盐水生产氯气,石墨电极上的电极反应式为_____________
氯氧化法是在一定条件下,用Cl2将废水中的CN﹣氧化成无毒的N2和CO2.该反应的离子方程式为_________
(2)氯胺(NH2Cl)消毒法是在用液氯处理自来水的同时通入少量氨气,发生反应:Cl2+NH3═NH2Cl+HCl,生成的NH2Cl比HClO稳定,且能部分水解重新生成HClO,起到消毒杀菌的作用.
氯胺能消毒杀菌的原因是 (用化学方程式表示).
(3)在水产养殖中,可以用Na2S2O3将水中残余的微量Cl2除去,某实验小组利用如图1所示装置和药品制备Na2S2O3.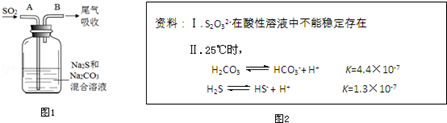
结合上述资料回答:
①开始通SO2时,在B口检测到有新的气体生成,判断从B口排出的气体中是否含有H2S,并写出判断依据__________________________.
②为获得较多的Na2S2O3,当溶液的pH接近7时,应立即停止通入SO2,其原因是 .
湿法炼锌的冶炼过程可用如图简略表示:
请回答下列问题:
(1)NH3的空间构型是 .氨气易液化,液氨常做制冷剂,氨气易液化的原因是_____________________.
(2)已知ZnO属于两性氧化物,写出ZnO与NaOH溶液反应的化学方程式: .
(3)上述电解过程中析出锌的电极反应式为 .
(4)产生的SO2可用Ba(NO3)2溶液吸收,部分产物可作为工业原料,其反应的离子方程式为
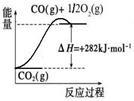
(5)氨是最重要的化工产品之一。合成氨用的氢气可以甲烷为原料制得:
CH4(g)+H2O(g) CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为_______________________.
CO(g)+3H2(g)。有关化学反应的能量变化如下图所示,则CH4(g)与H2O(g)反应生成CO(g)和H2(g)的热化学方程式为_______________________.

用含少量铁的氧化物的氧化铜制取氯化铜晶体(CuCl2·xH2O)。有如下操作:
已知:在pH为4~5时,Fe3+几乎完全水解而沉淀,而此时Cu2+却几乎不水解。
(1)溶液A中的金属离子有Fe3+、Fe2+、Cu2+。能检验溶液A中Fe2+的试剂为 (填编号,下同)。
①KMnO4 ②(NH4)2S ③NaOH④KSCN
(2)氧化剂可选用 。①Cl2 ②KMnO4 ③HNO3④H2O2
(3)要得到较纯的产品,试剂可选用 。①NaOH ②NH3.H2O ③Cu(OH)2④Cu2(OH)2CO3
(4)某同学设计以原电池的形式实现Fe2+至Fe3+的转化,电解质溶液为稀硫酸,请写出负极的电极反应: