(6分)化学在能源开发与利用中起着十分关键的作用。
(1)蕴藏在海底的“可燃冰”是高压下形成的外观象冰的甲烷水合物固体。甲烷气体燃烧和水汽化的热化学方程式分别为:
CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-802.3 kJ·mol-1,
H2O(l)===H2O(g) ΔH=+44 kJ·mol-1;
则356 g“可燃冰”(分子式为CH4·9H2O)释放的甲烷气体完全燃烧生成液态水,放出的热量为____ ;
(2)0.3 mol的气态高能燃料乙硼烷(B2H6)在氧气中燃烧,生成固态三氧化二硼和液态水,放出649.5 kJ热量,其热化学方程式为____________________________________;
(3)家用液化气中主要成分之一是丁烷(C4H10)。当1 g丁烷完全燃烧并生成CO2和液态水时,放出热量50 kJ。试写出丁烷燃烧热的热化学方程式_______________________
有以下物质:①NaCl晶体 ②液态SO3 ③液态的醋酸 ④汞 ⑤BaSO4固体 ⑥蔗糖(C12H22O11)水溶液 ⑦酒精(C2H5OH)⑧熔化K2SO4⑨纯水。请回答下列问题(用序号):
(1)以上物质中能导电的是__________
(2)以上物质属于电解质的是_____________
(3)以上物质中属于非电解质的是______________
雄黄(As4S4)和雌黄(As2S3)是提取砷的主要矿物原料,二者在自然界中共生。根据题意完成下列填空:
(1) As2S3和SnCl2在盐酸中反应转化为As4S4和SnCl4并放出H2S气体。写出该反应
并配平
(2)上述反应中的氧化剂是,反应产生的气体可用吸收。
(3) As2S3和HNO3有如下反应:
3As2S3+ 10H++ 28NO3—+ 4H2O=6H3AsO4+9SO42—+28NO↑
若生成2mol H3AsO4,则反应中转移电子的物质的量为mol。若将该反应设计成一原电池,则NO应该在(填“正极”或“负极”)附近逸出。
A、B、C、D、E、F、G是七种短周期主族元素,它们的原子序数依次增大,其中在元素周期表中A的原子半径最小,B和F、C和G分别是同一主族元素,含有D元素的物质焰色反应为黄色,G元素的最外层电子数是次外层电子数的3/4。又知B元素的最外层电子数是内层电子数的2倍,D、E、G三者的最高价氧化物的水化物两两皆能反应。请回答:
(1)A与C形成的原子个数比为1:1的化合物的电子式为,该物质含
键;它与GC2反应的化学方程式为
(2)D、E两者氧化物的水化物反应的离子方程式为;
(3)B、F的最高价氧化物(填化学式)的沸点高,理由是
(4)A、C、G间可以形成甲、乙两种负一价双原子阴离子,甲有18个电子,乙有10个电子,则甲与乙反应的离子方程式为。
广东省有着丰富的海洋资源。海水提取食盐和Br2以后的盐卤可以用来制备纯净的MgCl2或MgO。盐卤中含有Mg2+、Cl-,还含有少量Na+、Fe2+、Fe3+、SO42-等。制备流程如下图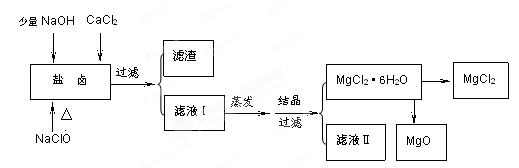
(1)滤液Ⅱ中所含主要的杂质离子是(写离子符号)。
(2) 加入NaClO的作用是。
(3)温度和压强P(HCl)g对MgCl2·6H2O晶体热分解产物的影响如图所示。
请回答下列问题:
①写出P(HCl)g = 0.25MPa,温度从300℃升高到550℃时反应的化学方程式;
②实际生产中,将MgCl2·6H2O晶体加热到600℃的过程中几乎得不到无水MgCl2,其原因是
;若要得到无水MgCl2须采取的措施是。
氮化硅(Si3N4)是一种新型陶瓷材料,它可由SiO2与过量焦炭在1300-1700oC的氮气流中反应制得3SiO2(s)+6C(s)+2N2(g) Si3N4(s)+6CO(g)
Si3N4(s)+6CO(g)
(1)已知该反应每转移1mole—,放出132.6kJ的热量,该方程式的?H =。
(2)能判断该反应(在体积不变的密闭容器中进行)已经达到平衡状态的是 。
A.焦炭的质量不再变化 B.N2和CO速率之比为1:3
C.生成6molCO同时消耗1mol Si3N4 D.混合气体的密度不再变化
(3)下列措施中可以促进平衡右移的是 。
A.升高温度B.降低压
C.加入更多的SiO2 D.充入N2
某温度下,测得该反应中N2和CO各个时刻的浓度如下,
| 时间/min |
0 |
5 |
10 |
15 |
20 |
25 |
30 |
35 |
40 |
45 |
| N2浓度/mol·L-1[ |
4.00 |
3.70 |
3.50 |
3.36 |
3.26 |
3.18 |
3.10 |
3.00 |
3.00 |
3.00 |
| CO浓度/mol·L-1 |
0.00 |
0.90 |
1.50 |
1.92 |
2.22 |
2.46 |
2.70 |
— |
— |
— |
求0—20 min内N2的平均反应速率V(N2 )=,该温度下,反应的平衡常数K=。