[化学——选修2:化学与技术](15分)
当今世界各国充分认识到海洋资源的重要性,海水的综合利用是当今的热点话题之一。
(1)利用海水脱硫可以有效地解决煤燃烧过程中排放的SO2造成的一系列环境问题。其工艺流程如图所示:
天然海水吸收含硫的烟气后,需要用氧气进行氧化处理,其反应的化学方程式是 :
氧化后的海水需要加入NaOH,与之混合后才能排放。该操作的主要目的是 。
(2)利用氯碱工业产品来处理含S02的烟气的流程如图所示: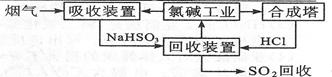
①“吸收装置”中发生反应的离子方程式是 。
②上述流程中循环利用的物质是 .
(3)空气吹出法是最早工业化海水提溴的方法,适合从低浓度含溴溶液中提取溴。
①通入空气吹出Br2,并用Na2C03吸收的目的是 。
②反应③中每生成3 mol Br2,转移电子的物质的 mol。
③为了除去工业Br2中微量的Cl2,可向工业Br2中 (填字母)。
a.通入HBr b.加入NaBr溶液
c.加入Na2C03溶液 d.加入Na2SO3溶液
(4)从海水中提纯粗盐后的母液中含有K+、Na+和Mg2+等阳离子。对母液进行一系列的加工可制得金属镁。
①从离子反应的角度思考,在母液中加入石灰乳所起的作用是 。
②电解熔融的无水氯化镁所得的镁蒸气在特定的环境中冷却后即为固体镁。下列物质中可以用作镁蒸气的冷却剂的是 (填字母)。
| A.Ar |
| B.C02 |
| C.空气 |
| D.02 |
E.水蒸气
太阳能的开发利用在新能源研究中占据重要地位.单晶硅太阳能电池片在加工时,一般掺杂微置的锎、硼、镓、硒等.
回答下列问題:
(1)二价铜离子的电子排布式为 .已知高温下Cu2O比CuO更稳定,试从铜原子核外电子结构变化角度解释
(2)(2)铜与类卤素(SCN)2反应生成Cu(SCN)2,1mol(SCN)2中含有π键的数目为_________.类卤素(SCN)2对应的酸有两种,理论上硫氰酸(H﹣S﹣C≡N )的沸点低于异硫氰酸(H﹣N=C=S)的沸点.其原因是 .
(3)硼元素具有缺电子性,其化合物可与具有孤电子对的分子或离子形成配合物,如BF3能与NH3反应生成BF3·NH3.在BF3·NH3中B原子的杂化方式为 ,B与N之间形成配位键,氮原子提供 .
(4)六方氮化硼晶体结构与石墨晶体相似,层间相互作用为 .六方氮化硼在高温高压下,可以转化为立方氮化硼,其结构和硬度都与金刚石相似,晶胞边长为361.5pm,立方氮化硼的密度是 g/cm3.(只要求列算式).
(5)如图是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置。
分研究NO2、SO2、CO等大气污染气体的处理及利用的方法具有重要意义。
(1)一定条件下,NO2与SO2反应生成SO3和NO两种气体。将体积比为1∶2的NO2、SO2气体置于密闭容器中发生上述反应,下列能说明反应达到平衡状态的是____________(填字母)。
a. 体系压强保持不变
b. 混合气体颜色保持不变
c. 体系中SO3的体积分数保持不变
d. 每消耗1 mol SO2的同时生成1 mol NO
测得上述反应平衡时NO2与SO2体积比为1∶6,则平衡常数K=____________。
(2)新型氨法烟气脱硫技术的化学原理是采用氨水吸收烟气中的SO2,再用一定量的磷酸与上述吸收产物反应。该技术的优点除了能回收利用SO2外,还能得到一种复合肥料,该复合肥料可能的化学式为________(写出一种即可)。
(3)右图是MCFC燃料电池,它是以水煤气(CO、H2)为燃料,一定比例Li2CO3和Na2CO3低熔混合物为电解质。A为电池的________(填“正”或“负”)极,写出B极电极反应式:________________________。
(4)工业上常用Na2CO3溶液吸收法处理氮的氧化物(以NO和NO2的混合物为例)。
已知:NO不能与Na2CO3溶液反应。
NO+NO2+Na2CO3===2NaNO2+CO2
2NO2+Na2CO3===NaNO2+NaNO3+CO2
① 用足量的Na2CO3溶液完全吸收NO和NO2的混合物,每产生22.4 L(标准状况)CO2(全部逸出)时,吸收液质量就增加44 g,则混合气体中NO和NO2的体积比为__________。
② 用Na2CO3溶液吸收法处理氮的氧化物存在的缺点是____________。
辉铜矿石主要含有硫化亚铜(Cu2S)及少量脉石(SiO2)。一种以辉铜矿石为原料制备硝酸铜的工艺流程如下:
(1)写出浸取过程中Cu2S溶解的离子方程式:____________________。
(2)回收S过程中温度控制在50~60℃之间,不宜过高或过低的原因是_____________。
(3)气体NOx与氧气混合后通入水中能生成流程中可循环利用的一种物质,该反应的化学方程式为_______________________;向滤液M中加入(或通入)下列__________(填字母)物质,得到另一种可循环利用的物质。
a.铁 b.氯气 c.高锰酸钾
(4)保温除铁过程中,加入CuO的目的是__________________;蒸发浓缩时,要用HNO3溶液调节溶液的pH,其理由是____________________。
分黄钾铵铁矾[KNH4Fex(SO4)y(OH)z]不溶于水和稀硫酸,制取黄钾铵铁矾的示意图如下: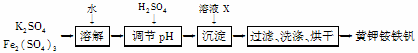
(1)溶液X是___________________。
(2)检验滤液中是否存在K+的操作是___________________。
(3)黄钾铵铁矾的化学式可通过下列实验测定:
①称取一定质量的样品加入稀硝酸充分溶解,将所得溶液转移至容量瓶并配制成100.00 mL溶液A。
②量取25.00 mL溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体9.32 g。
③量取25.00 mL溶液A,加入足量NaOH溶液,加热,收集到标准状况下气体224 mL,同时有红褐色沉淀生成。
④将步骤③所得沉淀过滤、洗涤、灼烧,最终得固体4.80 g。
通过计算确定黄钾铵铁矾的化学式(写出计算过程)。
分工业上利用锌焙砂(主要含ZnO、ZnFe2O4,还含有少量CaO、FeO、CuO、NiO等氧化物)制取金属锌的流程如图所示。回答下列问题: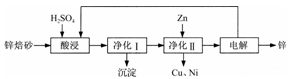
(1)酸浸时ZnFe2O4会生成两种盐,该反应的化学方程式为___________。
(2)净化Ⅰ操作分为两步:第一步是将溶液中少量的Fe2+氧化;第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下H2O2与Fe2+反应的离子方程式:___________。
②25 ℃时,pH=3的溶液中,c(Fe3+)=___________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ生成的沉淀中还含有溶液中的悬浮杂质,溶液中的悬浮杂质被共同沉淀的原因是_______________。
(3)若没有净化Ⅱ操作,则对锌的制备带来的影响是_________________。
(4)本流程中可以循环利用的物质除锌外还有________________。