某课外兴趣小组用下图装置进行实验,试回答: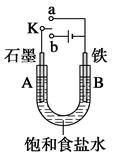
(1)若开始时开关K与a连接,则A电极反应式为_____________________。
(2)若开始时开关K与b连接,这种方法经常用于金属的防护,这种防护措施叫做 ,
则B电极反应式为______________________。开关K与b连接,铁和石墨棒互换位置即可制得白色的较纯净Fe(OH)2沉淀,则铁电极反应式为 。
(16分)已知A、B、C、D、E、F都是周期表中前四周期的元素,它们的核电荷数A<B<C<D<E<F,其中A、B、C是同一周期的非金属元素。化合物DC的晶体为离子晶体,D的二价阳离子与C的阴离子具有相同的电子层结构。A、C两元素可形成非极性分子AC2。E、F两元素同周期、同族,且原子序数相差2。请根据以上情况,回答下列问题:(答题时,A、B、C、D、E、F用所对应的元素符号表示)
(1)A、B、C的第一电离能由小到大的顺序为。
(2)B的氢化物的分子空间构型是。
(3)写出化合物AC2的结构式;一种由B、C组成的化合物与AC2互为等电子体,其化学式为。
(4)E原子的核外电子排布式是,
(5)B的最高价氧化物对应的水化物的稀溶液与D的单质反应时,B被还原到最低价,该反应的化学方程式是。
(6)若A与B两元素组成的晶体M,已知M具有与A元素形成的晶体相似的空间网状结构,请你判断晶体M与A元素的晶体硬度大小关系是:MA晶体(填>、<、=),并说明理由:________________________________。
将质量分数为98%,密度为1.84 g·cm-3的浓硫酸,用蒸馏水稀释到9.2 mol/L的硫酸,则其质量分数49%(填>、<、=)。
金属铜的提炼多从黄铜矿开始。黄铜矿的焙烧过程中主要反应之一的化学方程式为:2CuFeS2+O2= +2FeS+SO2,(方程式已配平)
+2FeS+SO2,(方程式已配平)
(1)方框中的物质应为_________
(2)若有1 molSO2 生成,则反应中电子转移数目为____ _____
(3)SO2是产物。
为了研究MnO2与双氧水(H2O2)的反应速率,某学生加入少许的MnO2粉末于 50 mL密度为1.1g∙cm-3的双氧水溶液中,通过实验测定:在标准状况下放出气体的体积和时间的关系如右图所示。请依图回答下列问题: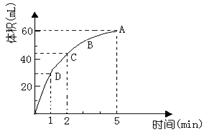
(1)实验时放出气体的总体积为 ___;
(2)放出一半气体所需要的时间为 ______;
(3)ABCD四点化学反应速率的由快到慢顺序为 ___________ ;
(4)在5min后,收集到的气体体积不再增加,原因是。
主族元素A、B、C、D都是短周期元素,A、D同主族,B、C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且最外层电子数是次外层电子数的2倍。A、B单质在常温下均为气体。它们在一定条件下以体积比2∶1完全反应,生成物在常温下是液体。此液体与D单质能剧烈反应生成A的单质。所得溶液中含有与氖原子的电子层结构相同的阳离子。
回答下列问题:
⑴A、B、C、D分别是 、 、 、 ;(填元素符号)
⑵D的离子结构示意图为 ,A与B形成的化合物的电子式为 ;
⑶B、C的气态氢化物稳定性由强到弱的顺序为:(写化学式,并用“<”或“>”表示强弱)。
(4)写出一种由A、B、C、D组成的化合物的化学式 。