短周期元素W、X、Y、Z的原子序数依次增大,W与Y、X与Z位于同一主族,W与X与可形成共价化合物WX2,Y原子的内层电子总数是其最外层电子数的2.5倍。下列叙述中不正确的是:
| A.WZ2分子中所有原子最外层都为8电子结构 |
| B.WX2、ZX2的化学键类型相同 |
| C.W形成的氢化物稳定性弱于X形成的氢化物稳定性 |
| D.原子半径大小顺序为X<W<Y<Z |
下列说法正确的是
| A.用活性炭去除冰箱中的异味是发生了化学反应 |
| B.用热碱水清除炊具上残留的油污,是因为Na2CO3可直接和油污反应 |
| C.用浸泡过高锰酸钾溶液的硅藻土保存水果 |
| D.漂白粉在空气中久置变质是因为漂白粉中的CaCl2与空气中的CO2反应生成CaCO3 |
下列叙述错误的是
| A.常温下,将pH=11的氨水和pH=3的盐酸等体积混合后,所得溶液中各离子浓度的关系是c(NH4+)>c(Cl-)>c(OH-)>c(H+) |
| B.在BaSO4饱和溶液中加入少量的BaCl2溶液产生沉淀,平衡后的溶液中: (Ba2+)×c(SO42-)>Ksp(BaSO4);c(Ba2+)>c(SO42-) |
C.某二元酸的电离方程式为H2B=H++HB-,HB- H++B2-,所以NaHB溶液呈酸性 H++B2-,所以NaHB溶液呈酸性 |
| D.等浓度的NH4HSO4、NH4Cl、NH3.H2O溶液中c(NH4+)逐渐减小 |
我国知名企业比亚迪公司开发了具有多项专利的锂钒氧化物二次电池,其成本较低,对环境无污染,能量密度远远高于其他电池,电池总反应为V2O5 + xLi  LixV2O5。下列说法合理的是
LixV2O5。下列说法合理的是
| A.电池在放电时,Li+向负极移动 |
| B.锂在放电时作正极,充电时作阳极 |
| C.该电池充电时阳极的反应为LixV2O5 _ xe-=V2O5 + xLi+ |
| D.V2O5只是锂发生反应的载体,不参与电池反应 |
如表所示的五种元素中,W、X、Y、Z为短周期元素,这四种元素的原子最外层电子数之和为22。下列说法正确的是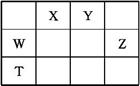
| A.X、Y、Z三种元素最低价氢化物的沸点依次升高 |
| B.由X、Y和氢三种元素形成的化合物中只有共价键 |
| C.物质WY2、W3X4、WZ4均有熔点高、硬度大的特性 |
| D.T元素的单质具有半导体的特性,T与Z元素可形成化合物TZ4 |
下述实验能达到预期目的是
| 编号 |
实验内容 |
实验目的 |
| A |
在滴有酚酞的Na2CO3溶液中,加入BaCl2溶液后红色褪去 |
证明Na2CO3溶液中存在水解平衡 |
| B |
将SO2通入酸性KMnO4溶液中,紫色褪去 |
证明SO2具有漂白性 |
C |
向1mL0.2mol/L NaOH溶液中滴入2滴0.1mol/L的MgCl2溶液产生白色沉淀后,再滴加2滴0.1mol/L的FeCl3溶液,又生成红棕色沉淀 |
证明在相同温度下,氢氧化镁的溶解度大于氢氧化铁的溶解度 |
| D |
测定等物质的量浓度的Na2SO3与Na2CO3溶液的pH,后者较大 |
证明非金属性S>C |