
 已知断开1 mol H2中的化学键需要吸收436KJ的能量,断开1 mol Cl2中的化学键需要吸收243KJ的能量,而形成1mol HCl分子中的化学键要释放431KJ的能量,则1mol氢气与1mol氯气反应时能量变化为:
已知断开1 mol H2中的化学键需要吸收436KJ的能量,断开1 mol Cl2中的化学键需要吸收243KJ的能量,而形成1mol HCl分子中的化学键要释放431KJ的能量,则1mol氢气与1mol氯气反应时能量变化为:
| A.吸收183KJ | B.吸收366KJ | C.放出183KJ | D.放出366KJ |
许多地区的自来水是利用氯气消毒的,为了检验Cl-的存在,最好选用下列物质中的( )
| A.紫色石蕊试液 | B.四氯化碳溶液 |
| C.氢氧化钠溶液 | D.硝酸银溶液 |
能把Na2SO4、NH4NO3、KNO3、(NH4)SO4四瓶无色溶液加以区别的一种试剂是(必要时可以加热)( )
| A.BaCl2 | B.NaOH |
| C.Ba(OH)2 | D.AgNO3 |
为了证明长期暴露在空气中的氢氧化钠浓溶液已部分变质,某同学先取2 mL试样于试管中,而后进行如下实验,其中不能达到目的的是( )
| A.加入少量盐酸,观察现象 | B.加入澄清石灰水,观察现象 |
| C.加入氯化钡溶液,观察现象 | D.通适量CO2气体,观察现象 |
按下列添加试剂的先后顺序,即可将盐酸、硫酸、硫酸钾、氢氧化钠和硝酸钾五种无色透明溶液鉴别开来的是( )
| A.石蕊溶液、AgNO3溶液、稀HNO3 |
| B.BaCl2溶液、酚酞溶液、AgNO3溶液 |
| C.石蕊溶液、BaCl2溶液 |
| D.酚酞溶液、BaCl2溶液、AgNO3溶液 |
以下是对某水溶液进行离子检验的方法和结论,其中正确的是( )
A.先加入BaCl2溶液,再加入足量的HNO3溶液,产生了白色沉淀。溶液中一定含有大量的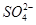 |
B.加入足量的CaCl2溶液,产生了白色沉淀。溶液中一定含有大量的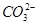 |
C.加入足量浓 NaOH溶液,产生了带有强烈刺激性气味的气体。溶液中一定含有大量的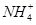 |
| D.先加适量的盐酸将溶液酸化,再加AgNO3溶液,产生了白色沉淀。溶液中一定含有大量的Cl- |