下表为元素周期表的一部分,请参照元素①一⑧在表中的位置,回答下列问题:
| 族 周期 |
I A |
ⅡA |
ⅢA |
ⅣA |
VA |
ⅥA |
ⅦA |
0 |
| 一 |
① |
|
||||||
| 二 |
|
|
|
② |
③ |
④ |
|
|
| 三 |
⑤ |
|
⑥ |
⑦ |
|
⑧ |
|
|
(1)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是 (写化学式)。
(2)由表中元素可以组成多种漂白剂,试写出其中两种常用漂白剂的化学式: 、 。
(3)①、④、⑤三种元素形成的化合物中化学键的类型: 。
(4)②和④形成的化合物与④和⑤形成的化合物之间发生氧化还原反应,写出该反应的化学方程式: 。
(5)由表中元素形成的常见物质X、Y、Z、M、W可发生以下反应: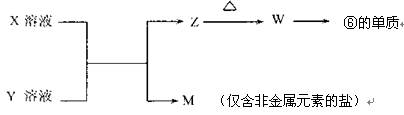
①X溶液与Y溶液反应的离子方程式为 ;
②已知M为硝酸盐,则M溶液中各离子浓度由大到小排列顺序为:
c( )>c( )>c( )>c( )(在括号内填离子符号)。
3,5—二甲氧基苯酚是重要的有机合成中间体,其合成反应如下:
该反应后的混合物含有:3,5—二甲氧基苯酚、甲醇、水和HCl。
已知:甲醇、乙醚和3,5—二甲氧基苯酚的部分物理性质如下表:
| 物质 |
沸点/℃ |
熔点/℃ |
密度(20℃)/(g/cm3) |
溶解性 |
| 甲醇 |
64.7 |
— |
0.7915 |
易溶于水 |
| 乙醚 |
34.5 |
— |
0.7138 |
难溶于水 |
| 3,5—二甲氧基苯酚 |
172 |
36 |
— |
易溶于甲醇、乙醚, 微溶于水 |
现在实验室对反应后的混合物进行分离提纯:
(1)利用与其它物质差异较大的特点,可先用蒸馏法分离出甲醇,蒸馏操作时使用的玻璃仪器有:酒精灯、、温度计、冷凝管 、接引管、锥形瓶。
(2)①蒸馏出甲醇后,加入乙醚进行、操作,有机层在分液漏斗的层。
②双项选择:选用乙醚这种试剂的主要原因是( )
A.乙醚易挥发
B.3,5—二甲氧基苯酚在乙醚中溶解度大于在水中的溶解度
C.乙醚难溶于水
D.3,5—二甲氧基苯酚熔点较低
(3)经上述步骤分离得到的有机层再用饱和NaHCO3溶液洗涤,其目的是。
(4)洗涤完成后,加入无水CaCl2干燥,过滤除去干燥剂,蒸馏除去乙醚,得到固体产物,为进一步提纯固体产物还要进行操作。
工业上利用某工厂的废渣(主要含CuO70%、MgFe2O420%,还含有少量FeO、NiO等氧化物)制取精铜和颜料铁红。流程如图所示。
回答下列问题:
(1)净化Ⅰ操作分为两步:
第一步是将溶液中少量的Fe2+氧化;
第二步是控制溶液pH,使Fe3+转化为Fe(OH)3沉淀。
①写出酸性条件下用H2O2氧化Fe2+反应的离子方程式:。
②25 ℃时,pH=3的溶液中,c(Fe3+)=___________mol·L-1(已知25 ℃,Ksp[Fe( OH)3]=4.0×10-38)。
③净化Ⅰ中第二步可选用CuO实现转化,用化学平衡移动原理说明其原因:
。
(2)用净化II所得的金属为电极进行电解得精铜,请写出阴极所发生的电极反应式:______________________________。
(3)为准确测定酸浸液中Fe2+的物质的量浓度以确定H2O2的用量,测定步骤如下:
①取出25.00mL酸浸液,配制成250.0mL溶液。
②滴定:准确量取25.00mL所配溶液于锥形瓶中,将0.2000mol/LKMnO4溶液装入
(填仪器名称),进行滴定,记录数据,重复滴定3次,平均消耗KMnO4溶液V mL。(反应离子方程式:5Fe2++MnO +10H+=5Fe3++Mn2++5H2O)
+10H+=5Fe3++Mn2++5H2O)
③计算酸浸液中Fe2+的物质的量浓度=mol/L (只列出算式,不做运算)。
工业上也可以用CO2和H2反应制得甲醇。在2×105Pa、300℃的条件下,若有44g CO2与6g H2恰好完全反应生成气体甲醇和水,放出49.5kJ的热量。试写出该反应的热化学方程式:。
某次实验将6molCO2和8molH2充入2L的密闭容器中,测得H2的物质的量随时间变化如下图所示(实线)。
试回答下列问题:
(1)a点正反应速率(填大于、等于或小于)逆反应速率。
(2)下列时间段平均反应速率最大的是,最小的是。
| A.0~1min |
| B.1~3min |
| C.3~8min |
| D.8~11min |
(3)计算该实验平衡时氢气的转化率和该条件下反应的平衡常数K(写出计算过程)。
(4)仅改变某一实验条件再进行两次实验,测得H2的物质的量随时间变化如图中虚线所示,曲线I对应的实验条件改变是,曲线II对应的实验条件改变是。
药物贝诺酯可以水杨酸为原料在一定条件下反应制得,主要反应过程如下:
请回答下列问题:
(1)水杨酸的分子式为:,它的含氧官能团分别名称为:和。
(2)1mol 水杨酸完全燃烧需要消耗mol O2。
(3)水杨酸溶液中加入几滴FeCl3溶液,溶液显色。
(4)反应①的反应类型为:,请写出水杨酸与足量NaOH溶液反应的化学方程式:。
(5)苯胺(C6H5—NH2)与乙酸酐在一定条件下发生类似①的反应,生成乙酰苯胺,试写出该反应的化学方程式:。
我国湖南、广西等地盛产的山苍子油中柠檬醛含量很高,质量分数可达到60%-90%,柠檬醛也可以利用异戊二烯为原料人工合成,柠檬醛又可用来合成紫罗兰酮等香精香料,其合成路线如下:
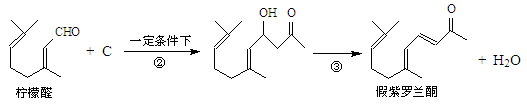

③同一碳原子连有两个双键结构不稳定。
试根据上述转化关系回答下列问题:
(1)写出A的结构简式,C的结构简式。
(2)①对应的反应条件是,反应③的反应类型是。
(3)写出B转化为柠檬醛的化学方程式。
(4)根据反应②的反应机理写出CH3CHO与足量的HCHO反应产物的结构简式:
。
(5)检验柠檬醛中含有碳碳双键的实验方法是:。
 (6)α-紫罗兰酮、β-紫罗兰酮有很多同分异构体,则满足下列条件的同分异构体有种。
(6)α-紫罗兰酮、β-紫罗兰酮有很多同分异构体,则满足下列条件的同分异构体有种。
①含有一个苯环②属于醇类且不能发生催化氧化反应
③核磁共振氢谱显示有5个峰