(12分)A、B、C是三种常见短周期元素的单质。常温下D为无色液体,E是一种常见的温室气体。其转化关系如图(反应条件和部分产物略去)。试回答:
(1)E的电子式是 。
(2)单质X和B或D均能反应生成黑色固体Y,Y的化学式是 。
(3)物质Z常用于对空气进行杀菌、净化和水果保鲜等。Z和B的组成元素相同,Z分子中各原子最外层电子数之和为18。Z和酸性碘化钾溶液反应生成B和碘单质,反应的离子方程式是 。
(4)取0.3 mol F与足量D充分混合后,所得溶液中再通入0.2 mol E充分反应,最后得到的水溶液中各种离子的浓度由大到小的顺序是(不考虑H+) 。
(5)E的大量排放会引发很多环境问题。有科学家提出,用E和H2合成CH3OH和H2O,对E进行综合利用。25℃,101 kPa时,该反应的热化学方程式是 。
(已知甲醇的燃烧热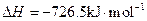 ,氢气的燃烧热
,氢气的燃烧热 )
)
二氧化锰是制造锌锰干电池的基本材料。工业上以软锰矿为原料,利用硫酸亚铁制备高纯二氧化锰的流程如 下:
下: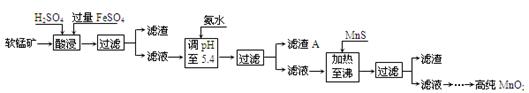
某软锰矿的主要成分为MnO2,还含有Si(16.72%)、Fe(5.86%)、Al(3.42%)、Zn(2.68%)和Cu(0.86%)等元素的化合物。部分阳离子以氢氧化物或硫化物的形式完全沉淀时溶液的pH见下表,回答下列问题:
| 沉淀物 |
Al(OH)3 |
Fe(OH)3 |
Fe(OH)2 |
Mn(OH)2 |
Cu(OH)2 |
Zn(OH)2 |
CuS |
ZnS |
MnS |
FeS |
| pH |
5.2 |
3.2 |
9.7 |
10.4 |
6.7 |
8.0 |
≥–0.42 |
≥2.5 |
≥7 |
≥7 |
(1)硫酸亚铁在酸性条件下将MnO2还原为MnSO4,酸浸时发生的主要反应的化学方程式为
(2)滤渣A的主要成分是。
(3)加入MnS的目的是除去杂质。
(4)碱性锌锰电池中总反应式:Zn+2MnO2+2H2O = 2MnOOH+Zn(OH)2
MnO2参与的电极反应方程式为。
(5)从废旧碱性锌锰电池中可以回收利用的物质有(写出两种)。
现有a·盐酸 b·硫酸 c·醋酸三种酸:(以下均用酸的序号填写)。
(1)在同体积,同pH的三种酸中,分别加入足量的碳酸钠粉末, 在相同条件下产生CO2的体积由大到小的顺 序是_________________。
序是_________________。
(2)在同体积、同浓度的三种酸中,分别加入足量的碳酸钠粉末,在相同条件下产生CO2的体积由大到小的顺序是_________________。
(3)物质的量浓度为0.1 mol·L-1的三种酸溶液的pH由大到小的顺序是___________;如果取等体积的0.1 mol·L-1的三种酸溶液,用0.1 mol·L-1的NaOH溶液中和,当恰好完全反应时,消耗NaOH溶液的体积由大到小的顺序是______________
钠和铝是两种重要的金属。请回答:
(1)将一小块金属钠投入水中,可观察到的实验现象是_____________(填序号)。
a.钠沉到水底 b.钠熔成小球 c.小球四处游动
(2)铝与氢氧化钠溶液反应的离子方程式为。
碳酸钠和碳酸氢钠是生活中常见的物质。请回答下列问题。
(1)碳酸钠俗称,其水溶液显性(填“酸”、“碱”或“中”)。等物质的量的碳酸钠和碳酸氢钠与足量盐酸反应时生成CO2的量,前者后者(填>、<或=)。
(2)碳酸氢钠可治疗胃酸(0.2%~0.4%的盐酸)过多,反应的离子方程式为。
(3)除去碳酸钠固体中碳酸氢钠的反应的化学方程式为。
氧化还原反应的实质是。铜跟氯气在点燃条件下发生反应:2Fe +3Cl2  2 FeCl3,其中氯元素的化合价_______(填“升高”或“降低”),被_________(填“氧化”或“还原”,下同);Cl2作_________剂,具有性。在该反应中,若消耗了1 mol Fe,则生成_______mol FeCl3。
2 FeCl3,其中氯元素的化合价_______(填“升高”或“降低”),被_________(填“氧化”或“还原”,下同);Cl2作_________剂,具有性。在该反应中,若消耗了1 mol Fe,则生成_______mol FeCl3。