实验室中做如下实验:一定条件下,在容积为2.0L的恒容密闭容器中,发生如下反应:2A(g)+B(g) 2C(g);△H =QkJ/mol
2C(g);△H =QkJ/mol
(1)若A、B起始物质的量均为零,通入C的物质的量(mol)随反应时间(min)的变化情况如下表:
| 实验 序号 |
 |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
| 1 |
8 0 0 ℃ |
1.0 |
0.80 |
0.67 |
0.57 |
0.50 |
0.50 |
0.50 |
| 2 |
8 0 0 ℃ |
n2 |
0.60 |
0. 50 |
0.50 |
0.50 |
0.50 |
0.50 |
| 3 |
8 0 0 ℃ |
n3 |
0.92 |
0.75 |
0.63 |
0.60 |
0.60 |
0.60 |
| 4 |
7 3 0 ℃ |
1.0 |
0.90 |
0.80 |
0.75 |
0.70 |
0.65 |
0.65 |
根据上表数据,完成下列填空:
①在实验1中反应在10至20min内反应的平均速率Vc= 实验2中采取的措施是 ;实验3中n3 1.0 mol(填“>、=、<”)。
②比较实验4和实验1,可推测该反应中Q 0(填“>、=、<”),
(2)在另一反应过程中A(g)、B(g)、C(g)物质的量变化如图所示,根据图中所示判断下列说法正确的是
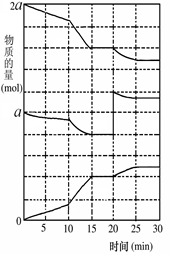
a.10~15 min可能是升高了温度
b.10~15 min可能是加入了催化剂
c.20 min时可能缩小了容器体积
d.20 min时可能是增加了B的量
(3)一定条件下,向上述容器中通入5molA (g)和3molB(g),此时容器的压强为P(始)。反应进行并达到平衡后,测得容器内气体压强为P(始)的 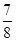 。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的
。若相同条件下,向上述容器中分别通入a molA(g)、b molB(g)、c molC(g),欲使达到新平衡时容器内气体压强仍为P(始)的 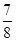 。
。
①a、b、c必须满足的关系是 (一个用a、c表示,另一个用b、c表示)
②欲使起始时反应表现为向正反应方向进行,则a的取值范围是
已知:A、C、J为日常生活中常见的金属单质,其中A、C均呈银白色,J呈紫红色。A是地壳中含量最高的金属元素,B是一种红棕色金属氧化物。它们之间的转化关系如下图。反应②在工业上可用于制作印刷电路板。请回答下列问题:
(1)写出C和I的化学式: , ;
(2)写出反应①的化学方程式: ,写出反应②的离子方程式: ;
(3)写出反应①在工业上的一种用途 。
某化学兴趣小组按照下列流程进行“由镁铝合金制备硫酸铝晶体”的实验。
(1)镁铝合金中加NaOH溶液的离子反应方程式为 ,画出金属X的原子结构示意图 ,固体A的化学式为 ;
(2)写出硫酸铝在水中的电离方程式 ,操作②包含的步骤有蒸发浓缩、 、过滤、干燥。
(3)该兴趣小组为测定镁铝合金中各组成的质量分数,设计如图装置,则需要测定的数据有 、 。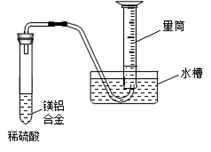
(1)某化学兴趣小组为了探究Cl2的相关性质,设计了如下的实验。
①写出Cl2与水反应的离子方程式 。
②通入Cl2后,从集气瓶A、B的现象可得出的结论是 ;从化学实验的安全环保角度考虑,你认为还应增加的装置是 。
(2)①如图所示,上述实验过程中,不会产生气体的是 ;
②写出反应D的化学方程式 。
(3)碘是人体中不可缺少的微量元素,食盐中加入碘元素能有效防止缺碘引起的疾病。以前在食盐中加入碘化钾(KI),放置一年后,碘流失约92%。现在食盐中加入碘酸钾(KIO3),在相同条件下碘仅损失约7%。
①食盐中加入碘化钾的碘损失率高的原因是 ;
②萃取碘水中的碘时,一般选用的试剂是(填字母) ;
A.酒精 B.四氯化碳 C.醋酸 D.硝酸银溶液
③可用盐酸酸化的碘化钾和淀粉溶液检验食盐中的碘酸钾。反应的化学方程式为:
5KI+KIO3 + 6HCl =" 6KCl" + 3I2 + 3H2O,反应的现象是 。
化学是一门以实验为基础的学科,化学所取得的丰硕成果,是与实验的重要作用分不开的。结合下列实验装置图回答问题:

I II
(1)写出上述图中仪器的名称:① ;② ;
(2)若利用装置I分离乙酸(沸点118℃)和乙酸乙酯(沸点77.1℃)的混合物,还缺少的仪器有 ,将仪器补充完整后进行的实验操作的名称为 ;实验时仪器②中冷却水的进口为 (选填“f”或“g”)。
(3)现需配制250 mL 0.2 mol·L-1 NaCl溶液,装置II是某同学转移溶液的示意图,图中有两处错误分别是 , 。
比较法是化学中研究物质性质的基本方法之一,请运用比较法解答下题。Na2O2几乎可与所有的常见气态非金属氧化物反应。如2Na2O2+2CO2 ="=" 2Na2CO3+O2,Na2O2+CO= Na2CO3。
(1)通过比较可知,当非金属元素处于____________价时,其氧化物与Na2O2反应有O2生成。
(2)试分别写出Na2O2与SO2、SO3反应的化学方程式:_____________;_____________。
(3)氰(CN)2的化学性质和卤素(X2)很相似,化学上称为拟卤素。试写出(CN)2与水反应的化学方程式:______________________________。