(本题14分)
合成氨是人类科学技术上的一项重大突破,其反应原理为:N2(g)+3H2(g) 2NH3(g)+Q(Q>0)
2NH3(g)+Q(Q>0)
一种工业合成氨的简易流程图如下:
完成下列填空:
28.天然气中的H2S杂质常用氨水吸收,产物为NH4HS。一定条件下向NH4HS溶液中通入空气,得到单质硫并使吸收液再生。NH4HS的电子式是_______________,写出再生反应的化学方程式:_______________。NH3的沸点高于H2S,是因为NH3分子之间存在着一种比_________力更强的作用力。
29.室温下,0.1 mol/L的氯化铵溶液和0.1 mol/L的硫酸氢铵溶液,酸性更强的是_______,其原因是_______。
已知:H2SO4:Ki2=1.2×10-2 NH3·H2O:Ki=1.8×10-5
30.图甲表示500℃、60.0MPa条件下,原料气投料比与平衡时NH3体积分数的关系。根据图中a点数据计算N2的平衡体积分数:______(答案用小数表示,保留3位有效数字)。
31.依据温度对合成氨反应的影响,在图乙坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,NH3物质的量变化的曲线示意图。

32.上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是(填序号)________。
简述本流程中提高合成氨原料总转化率的方法:________________________________。
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,回答下列问题: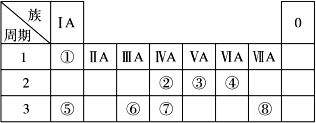
(1)地壳中含量居于第二位的元素在周期表中的位置是________________。
(2)②的最高价氧化物固态时的晶体类型:______________;⑦的最高价氧化物固态时的晶体类型:______________。
(3)①、④、⑤中的某些元素可形成既含离子键又含共价键的离子化合物,写出两种化合物的电子式______________,______________。若用球棍模型表示①和④形成的化合物的分子结构,应该是_____________。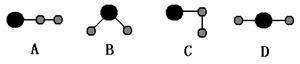
(4)W是第四周期与④同主族的元素。据此推测W不可能具有的性质是()
| A.最高正化合价为+6价, | B.气态氢化物比H2S稳定, |
| C.最高价氧化物的水化物的酸性比硫酸弱, | D.单质在常温下可与氢气化合。 |
(5) 已知X为ⅡA族元素(第一到第七周期),其原子序数为a,Y与X位于同一周期,且为ⅢA族元素,则Y的原子序数b与a所有可能的关系式___________________________。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应: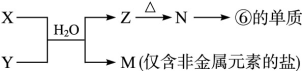
X溶液与Y溶液反应的离子方程式________, M中阳离子的鉴定方法____________。
Ⅰ.为了除去KCl溶液中少量的Mg2+、SO ,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作:
,可选用Ba(OH)2、HCl和K2CO3三种试剂,按如下步骤操作: 
(1)上述试剂中, B是,C是。
(2)操作Ⅱ的名称是。
(3)加过量A时发生有关反应的离子方程式为 、。
Ⅱ.一份无色稀溶液中可能含有Na+、Fe3+、H+、Mg2+、CO 、OH-、HCO
、OH-、HCO 、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
、Cl-等离子中的若干种。为了确定溶液的组成,进行了如下操作:
①用石蕊试纸测溶液的酸碱性,试纸显蓝色;
②取2毫升溶液,先加足量稀硝酸酸化,有气体产生,再加氯化钡溶液进行检验,没有明显现象;
(1)原溶液中一定存在的离子是,一定不存在的离子是。
(2)经过上述操作后,还不能肯定是否存在的离子是。请你设计一个简单的实验方案来判断是否存在这种离子。
Ⅰ.现有八种微粒:Na、Mg2+、Fe2+、Fe3+、S2-、SO2、HCl、H2O,从元素化合价的角度分析,其中只有氧化性的是______,只有还原性的是______,
既有氧化性又有还原性的是___________。
Ⅱ.已知能用氯酸钾与浓盐酸反应制取氯气,其化学方程式如下:
KClO3+6HCl=KCl+3Cl2↑+ 3H2O
⑴用单线桥在上述方程式中标出电子转移的方向和数目。
⑵标况下生成3.36LCl2,转移电子的物质的量为,被氧化的盐酸与未被氧化的盐酸质量之比为。氧化产物与还原产物物质的量之比为。
Ⅰ.某化学兴趣小组对下列三组物质进行研究:
A.HCl H2SO4 H2CO3 HNO3
B.溶液水悬浊液 胶体
C.Na2CO3 NaNO3 AgNO3 Ba(NO3)2
请你帮他们完善下列空白:
| A |
B |
C |
|
| 分类标准 |
含氧酸 |
分散系 |
|
| 不属于该类别的物质 |
Na2CO3 |
Ⅱ.现有下列物质:①铝②氢氧化铁胶体③氯化氢④SO2 ⑤NaHSO4固体⑥Ba(OH)2固体 ⑦稀硫酸⑧醋酸⑨烧碱⑩熔融NaNO3
(1)按物质的分类方法填写表格的空白处:(填编号)
| 分类标准 |
能导电的物质[ |
电解质 |
强电解质 |
| 属于该类的物质 |
(2)①与⑨的溶液反应的离子方程式为
(3)用Fe(OH)3胶体进行下列实验:
(a)将其装入U形管内,用石墨作电极,接通直流电,通电一段时间后发现阴极附的颜色逐渐变 (填“深”或“浅”),这表明 。
(b)向其中逐滴加入过量稀硫酸溶液,现象是_______ _______;
(4)向Ba(OH)2溶液逐滴加入NaHSO4溶液至恰好不再生成沉淀为止,写出此步的离子方程式 。
(1)18gH2O的物质的量是,含有个氢原子(填具体数字);这些H2O与 gOH-所含电子数相等。
(2)标准状况下,①6.72L CH4②3.01×1023HCl分子 ③0.2molNH3 ,这三种气体按物质的量由大到小排列的顺序是(填物质的数字代号,下同),按氢原子数由多到少排列的顺序是,密度由大到小排列的顺序是。