在下图所示的一些常见单质、化合物等物质之间的转化关系中(有些反应的条件和部分物质未全部列出),已知在常温常压下,F为红棕色气体;L为白色不溶于水的固体,它既能与盐酸反应又能与氢氧化钠反应;G是硝酸;J是无色气体,且能够使燃着的木条熄灭;A为金属单质,其氧化物具有两性;D为非金属气态单质,是大气中含量最多的物质;H为非金属固态单质,其原子核中有6个质子。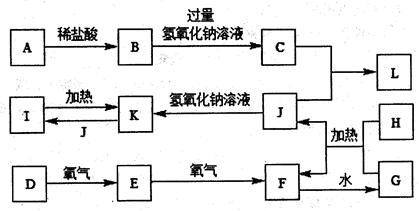
(1)化合物C的化学式为______________。
(2)物质I在生产生活中的用途有_______________(任答一条)。
(3)写出E+氧气→F的化学方程式:_________________________________________。
(4)写出A与稀盐酸反应的离子方程式:_____________________________________。
有相对分子质量为58的几种有机物,试写出符合条件的有机物的结构简式:
(1)若该有机物为烃,则可能的结构简式为:、。
(2)若该有机物是一种饱和一元醛,则其结构简式为:。
(3)若该有机物1mol能与足量银氨溶液作用可析出4molAg,则其结构简式为:。写出该物质的氧化产物与还原产物反应生成高聚酯的化学方程式。
(4)若该有机物能与金属钠反应,又能使溴的四氯化碳溶液褪色,则该有机物可能是:。(注羟基连在双键碳上的有机物极不稳定)
某物质只含C、H、O三种元素,其分子模型如图所示,分子中共有12个原子(图中球与球之间的连线代表单键、双键等化学键)。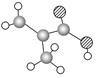
(1)该物质的结构简式为。
(2)该物质中所含官能团的名称为。
(3)下列物质中,与该产品互为同系物的是,与该产品互为同分异构体的是。(填序号)
①CH3CH="==CHCOOH"
②CH2===CHCOOCH3
③CH3CH2CH===CHCOOH
④CH3CH(CH3)COOH
合成氨对化学工业和国防工业有重要意义。若向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)关系图。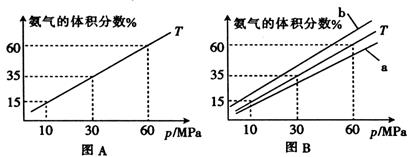
(1)图A中压强为10 MPA时,N2的转化率为
(2)已知:在合成氨反应中,升高温度H2的转化率降低。
①若图B中T=450℃,则温度为500℃时对应的曲线是(填“A”或“B”)
②该反应达到平衡时某物理量随温度变化如下图所示,纵坐标可以表示的物理量有
| A.H2的逆反应速率 |
| B.N2的质量百分含量 |
| C.NH3的的体积分数 |
| D.混合气体的平均相对分子质量 |
通常用燃烧的方法测定有机物的分子式,可在燃烧室内将有机物样品与纯氧在电炉加热下充分燃烧,根据产品的的质量确定有机物的组成。下图所示的是用燃烧法确定有机物分子式的常用装置。 现准确称取一定量某烃样品,经燃烧后A管增重2.2 g, B管增重1.08g。请回答:
现准确称取一定量某烃样品,经燃烧后A管增重2.2 g, B管增重1.08g。请回答:
(1)按上述所给的测量信息,装置的连接顺序应是:D
(2)C管中浓硫酸的作用是
(3)该有机物在纯氧中充分燃烧的化学方程式为(有机物用分子式表示)
(4)若该有机物分子中含有4个甲基,则该有机物的结构简式为
I.肼(N2H4)又称联氨,在常温下是一种可燃性的液体,可用作火箭燃料。 已知在25℃、l0lkPA时,16gN2H4在氧气中完全燃烧生成氮气和H2O,放出热量312kJ。
(1)该条件下,N2H4完全燃烧的热化学方程式为
(2)传统制备肼的方法是以NAClO氧化NH3,制得肼的稀溶液,该反应的方程式为
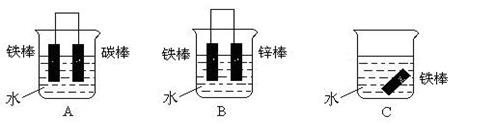
II.钢铁工业是国家工业的基础。请回答钢铁腐蚀、防护过程中的有关问题。
(1)铁在潮湿的空气中容易被腐蚀,写出铁发生电化学腐蚀时,负极的电极反应式
(2)下图是实验室研究海水对铁闸不同部位腐蚀情况的剖面示意图。图中A、B、C、D四个区域,生成铁锈最多的是(填字母)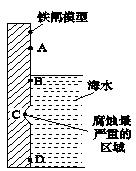
(3)下列各个装置中铁棒被腐蚀由难到易的顺序是______(填字母)