合成氨对化学工业和国防工业有重要意义。若向合成塔中按物质的量之比l:4充入N2、H2进行氨的合成,图A为T℃时平衡混合物中氨气的体积分数与压强(p)关系图。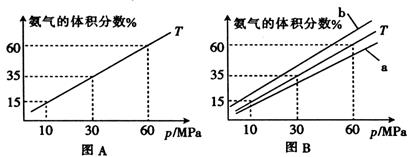
(1)图A中压强为10 MPA时,N2的转化率为
(2)已知:在合成氨反应中,升高温度H2的转化率降低。
①若图B中T=450℃,则温度为500℃时对应的曲线是 (填“A”或“B”)
②该反应达到平衡时某物理量随温度变化如下图所示,纵坐标可以表示的物理量有 
| A.H2的逆反应速率 |
| B.N2的质量百分含量 |
| C.NH3的的体积分数 |
| D.混合气体的平均相对分子质量 |
A是一种重要的化工原料,A的产量可以用来衡量一个国家的石油化工水平,C是家庭中常用的一种调味品的主要成分,D是具有果香气味的物质。A、B、C、D在一定条件下存在如下转化关系(部分反应条件、产物被省略)。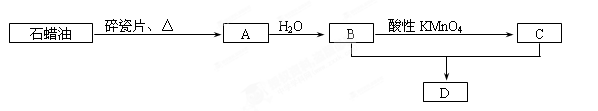
(1)A、B、C中含有的官能团分别是,,(写名称)
(2)写出反应的化学方程式
A→B:反应类型:
B+C→D:反应类型:
(3)B在Cu作催化剂的情况下可催化氧化,其方程式为
下表为元素周期表的一部分,请参照元素①~⑧在表中的位置,用化学用语回答下列问题:

(1)上述十种元素中,最高价氧化物水化物酸性最强的化合物的化学式是,(填化学符号,下同),最高价氧化物水化物碱性最强的化合物的化学式是,最高价氧化物水化物显两性的氢氧化物的化学式是。
(2)③与④的气态氢化物的稳定性由大到小的顺序是。
(3)④、⑤、⑥的离子半径由大到小的顺序是__________________。
(4)②、③、⑦的最高价含氧酸的酸性由强到弱的顺序是______________。
(5)①、④、⑤、⑧中的某些元素可形成既含离子键又含极性共价键的化合物,写出其中一种化合物的电子式:______________。
(6)由表中元素形成的常见物质X、Y、Z、M、N可发生以下反应:
X溶液与Y溶液反应的离子方程式为______________________________________。
茉莉花香气的成份有多种,乙酸苯甲酯(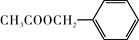 )是其中的一种,它可以从茉莉花中提取。一种合成路线如下:
)是其中的一种,它可以从茉莉花中提取。一种合成路线如下: 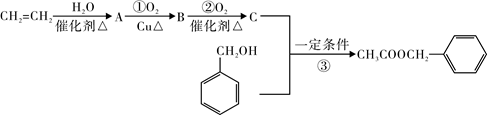
回答下列问题:
(1)A物质的官能团是,C的结构简式为。
(2)反应③的反应类型为。
(3)写出反应①的化学方程式:。
(4)乙烯合成聚乙烯塑料的化学方程式是。
(5)①②③反应中哪个反应的原子理论利用率为100%,符合绿色化学的要求。
(填序号)
近年来,酸雨污染较为严重,防治酸雨成了迫在眉睫的问题。
(1)火力发电厂为除去有害气体SO2,并变废为宝,常采用尾气脱硫工艺,如图所示。写出尾气脱硫工艺中反应的化学方程式:。
(2)宁波的火力发电厂通常建在海边,一般海水呈弱碱性,主要含有Na+、Mg2+、K+、Ca2+、Cl-、Br-、SO42-、HCO3-等离子。含有SO2的烟气也可以利用海水脱硫,其工艺流程如下图所示:
①向曝气池通入空气的目的是。
②通入空气后的曝气池中的海水与天然海水相比,浓度有明显不同的离子是。
| A.Cl- | B.Na+ | C.Mg2+ | D.HCO3- |
(3)有人提出了一种利用氯碱工业产品处理含二氧化硫废气的方法,将含SO2的废气通入电解饱和食盐水后所得到的NaOH溶液中,得NaHSO3溶液。写出得到NaHSO3溶液的离子方程式:。
A、B、C、D、E五种短周期元素,它们的原子序数依次增大。A是元素周期表中原子半径最小的元素,B元素原子L层上的电子数为K层电子数的2倍;元素D的2价阴离子的核外电子排布与氖原子相同;E与A同主族;A和E这两种元素与D都能形成X2Y、X2Y2型化合物。请回答:
(1)写出元素的符号:C;E 。
(2)化合物A2D的电子式为。
(3)元素B的一种同位素可测定文物年代,这种同位素的符号是。
(4)B的最高价氧化物的结构式。
(5)写出符合X2Y2的物质在MnO2催化作用下生成D单质的方程式。