. A 、B、 C、 D、 E是中学常见的5种化合物,A 、B是氧化物,元素X、Y的单质是生活中常见的金属,相关物质间的关系如下图所示。
(1)X的单质与A反应的化学方程式是
(2)若试剂1和试剂2均是稀硫酸。
①如何验证D中的金属离子已全部转化为E:
②物质C溶于水有净水作用,原因是:
③某高效净水剂是由Y(OH)SO4聚合得到的。工业上以E、稀硫酸和亚硝酸钠
为原料来制备Y(OH)SO4,反应中有NO生成,该反应的化学方程式是
(3)若试剂1是NaOH溶液,X的单质与试剂1反应的离子方程式是
燃烧法是测定有机化合物化学式的一种重要方法。在一定温度下取0.1 mol某液态烃A在O2中完全燃烧,生成CO2和水蒸汽,将生成物依次通过浓硫酸和碱石灰,浓硫酸增重16.2 g,碱石灰增重35.2 g。
(1)写出烃A的分子式;
(2)含三个甲基的烃A同分异构体的数目为;
(3)烃A的一种同分异构体,其一氯代物只有一种,写出该同分异构体的结构简式;
现有A、B、C、D四种元素,A元素形成的—2价阴离子比氦原子的核外电子数多8个,B元素形成的一种化合物为淡黄色固体,该固体遇到空气能生成A的单质;C为原子核内有12个中子的金属元素,当2.4g C与足量热水反应时,在标准状况下放出气体2.24L,C形成正二价阳离子;D元素原子的M层上有7个电子。
(1)写出C的元素符号:C;
(2)指出D在周期表的位置:;
(3)B的最高价氧化物的水化物的电子式为,所含的化学键类型为;
(4)D的气态氢化物、H2S、HF的热稳定性由强到弱顺序是:(用化学式表示);
(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是(填“吸热”或“放热”)反应,NO2和CO的总能量(填“>”、“<”或“=”)CO2和NO的总能量。
(2)在某体积为2L的密闭容器中充入0.5mol NO2和1mol CO,在一定条件下发生反应:NO2+CO CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
①该段时间内,用CO2表示的平均反应速率为。
②假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量为。
③下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是
| A.容器内气体的质量保持变 | B.NO2的物质的量浓度不再改变 |
| C.容器内气体的平均相对分子质量不变 | D.NO2的消耗速率与CO2的消耗速率相等 |
E.容器内气体的物质的量保持不变
(6分)下列各组中的两种有机物,可能是相同的物质.同系物或同分异构体等,请判断它们之间的关系
(1)2-甲基丁烷和丁烷 ________________(2)新戊烷和2,2-二甲基丙烷_____________
(3)1,3-二甲基苯和乙苯 _____________________
有机物的结构简式可进一步简化,如:


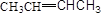

(1)写出下列有机物的结构简式
2,2,3,3-四甲基戊烷 3,4-二甲基-4-乙基庚烷
(2)写出下列物质的分子式并用系统命名法命名:

,,