(1)20世纪30年代,Eyring和Pzer在碰撞理论的基础上提出化学反应的过渡态理论:化学反应并不是通过简单的碰撞就能完成的,而是在反应物到生成物的过程中经过一个高能量的过渡态。如图是NO2和CO反应生成CO2和NO过程中的能量变化示意图,说明这个反应是 (填“吸热”或“放热”)反应,NO2和CO的总能量 (填“>”、“<”或“=”)CO2和NO的总能量。
(2)在某体积为2L的密闭容器中充入0.5mol NO2和1mol CO,在一定条件下发生反应:NO2+CO CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
CO2+NO,2 min时,测得容器中NO的物质的量为0.2 mol ,则:
①该段时间内,用CO2表示的平均反应速率为 。
②假设此反应在5 min时达到平衡,则此时容器内气体的总物质的量为 。
③下列事实能够说明上述反应在该条件下已经达到化学平衡状态的是
| A.容器内气体的质量保持变 | B.NO2的物质的量浓度不再改变 |
| C.容器内气体的平均相对分子质量不变 | D.NO2的消耗速率与CO2的消耗速率相等 |
E.容器内气体的物质的量保持不变
0.1 mol某烃在足量的氧气中完全燃烧,生成CO2和水各0.6 mol,则该烃的分子式为。若该烃不能使溴水或高锰酸钾溶液褪色,但在一定条件下,可以和液溴发生取代反应,其一溴取代物只有一种,则此烃属于烃,结构简式为,该取代反应的化学方程式为______________。
若该烃能使溴水褪色,且能在催化剂作用下与H2发生加成反应,生成2.2—二甲基丁烷,则此烃属于烃,结构简式为,该加成反应的化学方程式为。
(1)科学家通过X射线推测胆矾结构示意图可简单表示如下,图中虚线表示的作用力分别为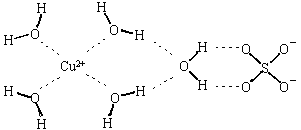
(2)在硫酸铜溶液中逐滴滴加氨水至过量,先出现蓝色沉淀,最后溶解形成深蓝色的溶液。写出此蓝色沉淀溶解的离子方程式:;
(3)SiCl4与SO42一互为等电子体,预测SO42一的空间构型为
(1)前三周期元素中第一电离能最小的是___________ (填元素符号),其基态原子的电子排布式为______________________。第二周期非金属元素形成的氢化物中化学键极性最大的是__________(填分子式)。
(2)物质形成分子间氢键和分子内氢键对物质性质的影响有显著差异。根据下表数据,形成分子间氢键的物质是___________ (填物质字母代号)。
| 代号 |
物质 |
结构简式 |
水中溶解度/g (25℃) |
熔点/℃ |
沸点/℃ |
| A |
邻—硝基苯酚 |
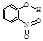 |
0.2 |
45 |
100 |
| B |
对—硝基苯酚 |
 |
1.7 |
114 |
295 |
(3)电负性的大小:C___________O,键能的大小:HBr___________HI。(填“>”、“=”或“<”)
氯化铬酰(CrO2Cl2)在有机合成中可作氧化剂或氯化剂,能与许多有机物反应。请回答下列问题:
⑴写出基态铬原子的外围轨道表示式_______________________________,与铬同周期的所有元素的基态原子中最外层电子数与铬原子相同的元素有____________(填元素符号),其中一种金属的晶胞结构如右图所示,该晶胞中含有金属原子的数目为________。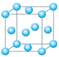
⑵CrO2Cl2常温下为深红色液体,能与CCl4、CS2等互溶,据此可判断CrO2Cl2是__________(填“极性”或“非极性”)分子。
⑶在①苯、②C2H4、③CCl4、④CO2五种有机溶剂中,碳原子采取sp2杂化的分子有___________(填序号),CO2分子的空间构型是______________。
、某芳香族化合物A的水溶液呈酸性,测得A分子中无酚羟基。A可发生下图所示转化,其中F为五元环状化合物;G可使溴的四氯化碳溶液褪色;F和G互为同分异构体;H和I都是医用高分子材料。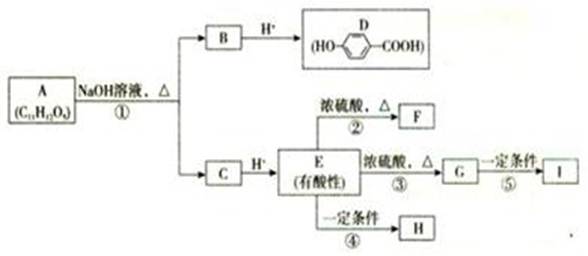
请回答:
(1)E中的官能团名称是羟基、 。
(2)③的反应类型是 。
(3)②的化学方程式是 。
(4)A与H的结构简式分别是 、 。
(5)D与足量X溶液反应后可得到C7H5O3Na,则X溶液中所含溶质的化学式是 。
(6)写出符合下列条件的G的同分异构体:
①能发生水解反应
②分子中不含环状结构
③核磁共振氢谱显示分子中有4种不同化学环境的氢原子
④能发生银镜反应,分子中有甲基