氧化铜矿石含有CuO和Cu2(OH) 2CO3,还含有Fe2O3、FeO和SiO2等。铜、铁是畜禽所必需的微量元素。某饲料厂联合生产硫酸铜和硫酸亚铁工艺流程如下:

(1)氧化铜矿石粉碎的目的是 。
(2)写出“酸浸”中Cu2(OH) 2CO3发生反应的离子方程式 。
(3)“中和/过滤”中加入CaCO3的目的是 。
(4)上述工艺流程中多处涉及“过滤”,实验室中过滤操作需要使用的玻璃仪器有 。
(5)加入铁屑的作用是 、 。
(6)下表和下图为“烘干粉碎”的试验结果。

硫酸亚铁干燥曲线图
| 序号 |
t/h |
t/℃ |
m/g |
x |
| 1 |
3 |
80 |
5 |
4 |
| 2 |
3 |
160 |
10 |
1 |
| 3 |
4 |
160 |
10 |
0.8 |
| 4 |
4 |
160 |
5 |
0 |
| 5 |
5 |
80 |
5 |
3 |
| 6 |
5 |
160 |
15 |
1 |
表2.硫酸铜晶体(CuSO4·5H2O)干燥试验表
表2中,m为CuSO4·5H2O晶体的质量,x为干燥后所得晶体中结晶水的个数。据此可确定由CuSO4·5H2O和FeSO4·7H2O脱水得流程中所示产品的适宜工艺条件分别为 , (分别指出两条件的温度和时间)。
将0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合,测得混合溶液中c(Na+)>c(A-),则(用“>”、“<”或“=”填写下列空白):
(1)混合溶液中c(A-)______c(HA);
(2)混合溶液中c(HA)+c(A-)______0.1 mol·L-1;
(3)混合溶液中由水电离出的c(OH-)__________0.2 mol·L-1HA溶液中由水电离出的
c(H+);
(4)25°C时,如果取0.2 mol·L-1HA溶液与0.1 mol·L-1NaOH溶液等体积混合,测得混合溶液的pH<7,则HA的电离程度______NaA的水解程度。
物质在水中可能存在电离平衡、盐的水解平衡和沉淀的溶解平衡。请根据所学知识回答下列问题:
(1)NaHCO3溶液中共存在7种微粒,它们是Na+、HCO 、H+、CO
、H+、CO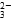 、H2O、________、________(填写微粒符号)。
、H2O、________、________(填写微粒符号)。
(2)常温下,物质的量浓度均为0.1 mol·L-1的六种溶液①NH4NO3、②NaCl、③Na2CO3、④H2SO4、⑤NaOH、⑥CH3COONa,pH从大到小排列顺序为____________。
(3)常温时,AlCl3的水溶液呈________(填“酸”、“中”、“碱”)性,原因是(用离子方程式表示):_______________________________________
实验室在配制AlCl3的溶液时,为了抑制AlCl3的水解可加入少量的________(填写物质的名称),把AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是________。
(4)常温下,物质的量浓度相同的下列溶液:①NH4Cl、②(NH4)2SO4、③NH3·H2O、④(NH4)2CO3、⑤NH4HSO4。溶液中c(NH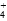 )从大到小的顺序为:____________(填序号)。
)从大到小的顺序为:____________(填序号)。
实验室有一瓶混有氯化钠的氢氧化钠固体试剂,经测定氢氧化钠的质量分数约为82%,为了验证其纯度,用浓度为0.2 mol·L-1的盐酸进行滴定,完成下列问题:
(1)称取5.0 g该氢氧化钠固体样品,配成500 mL溶液备用。
(2)将标准盐酸装在25.00 mL的________滴定管中,调节液面位置在“0”刻度以下,并记录下刻度。
(3)取20.00 mL待测液。该项实验操作使用的主要仪器有________。用酚酞作指示剂时,滴定到溶液颜色由________色刚好变成________色为止。
(4)滴定达终点后,记下盐酸用去20.00 mL,计算氢氧化钠的质量分数为________。
(5)试分析上述滴定误差可能由下列哪些实验操作引起________(填序号)。
| A.转移待测液至容量瓶时,未洗涤烧杯 |
| B.酸式滴定管用蒸馏水洗涤后,直接装盐酸 |
| C.滴定时反应器摇动太激烈,有少量液体溅出 |
| D.滴定到终点时,滴定管尖嘴悬有气泡 |
E.滴定开始时读数仰视,终点时读数俯视
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验。
实验一:配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对稀释后醋酸溶液的浓度进行标定。回答下列问题:
(1)配制250 mL 0.2 mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________和________。
(2)为标定某醋酸溶液的准确浓度,用0.2000 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 |
1 |
2 |
3 |
4 |
| 消耗NaOH溶液的体积(mL) |
20.05 |
20.00 |
18.50 |
19.95 |
则该醋酸溶液的准确浓度为__________(保留小数点后四位)。
实验二:探究浓度对醋酸电离程度的影响
用pH计测定25°C时不同浓度的醋酸的pH,结果如下:
| 醋酸浓度(mol/L) |
0.0010 |
0.0100 |
0.0200 |
0.1000 |
0.2000 |
| pH |
3.88 |
3.38 |
3.23 |
2.88 |
2.73 |
回答下列问题:
(3)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是
____________________________________________________
(4)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度________(填“增大”、“减小”或“不变”)。
(5)实验三:该同学用pH计测定相同浓度的醋酸在几种不同温度时的pH,该同学的实验目的是:____________________________________________
一种“人工固氮”的新方法是在常温、常压、光照条件下,N2在催化剂表面与水发生反应生成NH3:N2+3H2O 2NH3+O2
2NH3+O2
进一步研究NH3生成量与温度的关系,部分实验数据见下表(反应时间3 h):
| T/℃ |
30 |
40 |
50 |
| 生成NH3量/(10-6 mol) |
4.8 |
5.9 |
6.0 |
请回答下列问题:
(1)50℃时从开始到3 h内以O2物质的量变化表示的平均反应速率为________ mol·h-1。
(2)该反应过程与能量关系可用如图表示,则反应的热化学方程式是____________。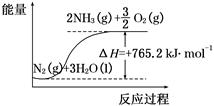
(3)与目前广泛应用的工业合成氨方法相比,该方法中固氮反应速率较慢。请提出可提高其反应速率且增大NH3生成量的建议:_______________________________________。
(4)工业合成氨的热化学方程式为N2(g)+3H2(g)  2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
2NH3(g) ΔH=-92.4 kJ·mol-1。在某压强恒定的密闭容器中加入2 mol N2和4 mol H2,达到平衡时,N2的转化率为50%,体积变为10 L。求:
①该条件下的平衡常数为________;
②若向该容器中加入a mol N2、b mol H2、c mol NH3,且a、b、c均大于0,在相同条件下达到平衡时,混合物中各组分的物质的量与上述平衡相同。反应放出的热量________(填“>”“<”或“=”)92.4 kJ。