(8分)常温下,用0.1000 mol/L NaOH溶液分别滴定20.00 mL 0.1000 mol/L HCl溶液和
20.00 mL 0.1000 mol/L CH3COOH溶液,得到2条滴定曲线,如下图所示: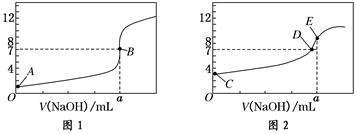
(1)由A、C点判断,滴定HCl溶液的曲线是______(填“图1”或“图2”);
(2)a=________ mL;
(3)c(Na+)=c(CH3COO-)的点是________;
(4)E点对应离子浓度由大到小的顺序为________________。
下表是不同温度下水的离子积数据:
| 温度(℃) |
25 |
t1 |
t2 |
| 水离子积常数 |
1×10-14 |
α |
1×10-12 |
试回答下列问题:
(1)若25<t1<t2,则α(填“>”、“>”或“=”)1×10-14,作出此判断的理由是。
(2)在t1时,测得纯水中的c(H+)=2.4×10-7mol/L,则c(OH-)为。该温度下,测得某H2SO4溶液中c(SO42-)=5×10-6 mol·L-1,该溶液中c(OH-)=mol·L-1。
(3)t2℃下:①0.01 mol·L-1的氢氧化钠溶液的pH=。
②若10体积的某强酸溶液与1体积的某强碱溶液混合后溶液呈中性,则混合之前,该强酸的pH值pH1与强碱的pH值pH2之间应满足的关系是。
一定温度下在体积为5L的密闭容器中发生可逆反应。
(I)若某可逆反应的化学平衡常数表达式为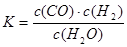 ,写出该反应的化学方程式_________.
,写出该反应的化学方程式_________.
(Ⅱ)若该密闭容器中加入的是2molFe(a)与1molH2O(g),发生3Fe(s)+4H2O(g)  Fe3O4(s)+4H2(g)∆H<0,t1秒时,H2的物质的量为0.20mol,到第t2称时恰好达到平衡。此时H2的物质的量为0.35mol。
Fe3O4(s)+4H2(g)∆H<0,t1秒时,H2的物质的量为0.20mol,到第t2称时恰好达到平衡。此时H2的物质的量为0.35mol。
(1)t1-t2这段时间内的化学反应速率v(H2)____________________________。
(2)若继续加人2molFe(s),则平衡_______移动(填“向正反应方向”、“向逆反应方向”或“不”).
(3)该反应的逆反应速率随时间变化的关系如图。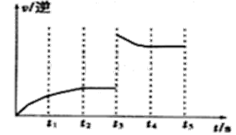
t3时改变了某种条件.改变的条件是___________。
已知:C(s,石墨)+O2(g)=CO2(g) △H1=-393kJ·mol-1
2H2(g)+O2(g)=2H2O(l) △H2=-572kJ·mol-1
2C2H2(g)+5O2(g)=4CO2(g)+2H2O(l) △H3=-2598kJ·mol-1
根据盖斯定律,计算298K时由C(s,石墨)和H2(g)生成1mol C2H2(g)反应的焓变:△H=_____。
在10L容器中,加入2mol的SO2(g)和2mol的NO2(g),保持温度恒定,发生反应:SO2(g)+NO2(g) SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。
SO3(g)+NO(g)。当达到平衡状态时,测得容器中SO2(g)的转化率为50%。
(1)该温度下的该反应的平衡常数=__________________(用数值表示)
(2)该温度下、该容器中,再继续加入1mol的SO2(g),则:
化学平衡将向________方向移动,NO2的转化率将____________;
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程。
将水蒸气通过红热的碳即可产生水煤气。反应为:
C(s)+H2O(g) CO(g)+H2(g) ΔH="+131.3" kJ•mol-1,ΔS=+133.7J•(K•mol) -1
CO(g)+H2(g) ΔH="+131.3" kJ•mol-1,ΔS=+133.7J•(K•mol) -1
①该反应能否自发进行与有关。
②一定温度下,在一个容积可变的密闭容器中,发生上述反应,下列能判断该反应达到化学平衡状态的是(填字母,下同)
a.容器中的压强不变
b.1 mol H—H键断裂的同时断裂2 molH—O键
c.υ正(CO) =υ逆(H2O)
d.c(CO)=c(H2)