已知:
RCH2COOH+Br2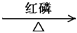 RCH(Br)COOH+HBr(R为烃基)
RCH(Br)COOH+HBr(R为烃基)
有一常用于香料工业的芳香族化合物名叫桂酸叶酯。其合成路线如下图所示: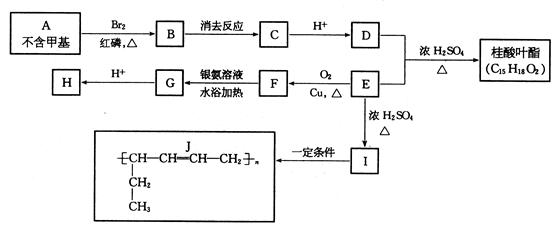
试回答:(1)I的结构简式是 ;
E分子含有的官能团是 (写名称);
(2)BgC的反应条件是 ; FgG反应类型 (填编号);
a. 还原反应 b. 氧化反应 c. 取代反应 d. 消去反应
(3)A的结构简式是 ;
(4)写出下列化学方程式:
EgF ;
D发生的加聚反应 ;
(5)写出桂酸叶酯的结构简式: 。
(6)E的同分异构体中属于醛类且分子中含有3个甲基的结构有_______种。
向200 mL ,某物质的量浓度的NaOH溶液中缓慢通入一定量的CO2,充分反应,测得最后溶液的pH>7。
(1)此时溶液的溶质如果是单一成分,可能是____________________ ;如果是多种成分,可能是__________________________。
;如果是多种成分,可能是__________________________。
(2)在上述所得溶液中,逐滴缓慢滴加2 mol·L-1的盐酸,所得气体(不考虑溶解于水)的体积与所加盐酸的体积关系如图所示: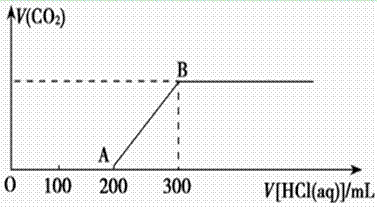
①加入盐酸200 mL之前,无气体产生,写出OA段发生反应的离子方程式_______________ ____________________________________________________。
____________________________________________________。
②B点时,反应所得溶液中溶质的物质的量浓度是__________ (溶液体积的变化忽略不计)。
(8分)"比较"是化学研究物质性质的基本方法之一,请运用比较法解答下列问题.已知在一定条件下,过氧化钠几乎可与所有的常见气态非金属氧 化物反应。
化物反应。
如:2Na2O2+2CO2=2Na2CO3+O2,Na2O2+CO=Na2CO3。
(1)试分别写出Na2O2与SO2、SO3反应的化学方程式。
(2)当1molSO3参加反应时,转移电子的物质的量为mol。
(3)通过比较可知:在氧化物中,当非金属元素处于 价时,其氧化物与过氧化钠反应就有O2生成。
价时,其氧化物与过氧化钠反应就有O2生成。
盐酸、硫酸和硝酸是中学阶段常见的三种强酸。请就三者与金属铜的反应情况,回答下列问题:
(1)①在100mL 1 8 mol·L-1的浓硫酸中加入过量的铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是
| A.40.32L | B.30.24L | C.20.16L | D.6.72L |
②有同学提出,若使上述反应①中剩余的铜片继续溶解,可向其中加入硝酸钠,请判断该方案是否可行?若 不可行,请说明原因。若可行,请写出反应的离子方程式:。
不可行,请说明原因。若可行,请写出反应的离子方程式:。
(2)若将6.4g铜粉与一定量浓硝酸反应,当铜粉完全溶解时,生成气体(NO、NO2)共2.24L(标准状况),则反应中所消耗的硝酸的物质的量为。
(3)某同学向浸泡铜片的稀盐酸中加入H2O2后,铜片溶解,并且该反应的产物只有氯化铜和水。该反应的化学方程式为:。
铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备氧化铝的主要原料。工业上提取氧化铝的工艺流程如下图所示,请回答有关问题: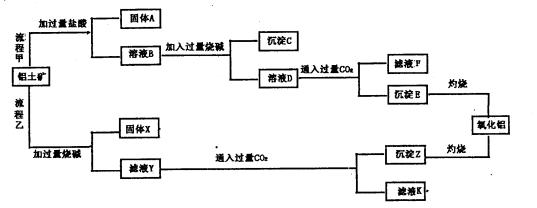
(1)流程乙加入烧碱后发生反应 的离子方程式:.
的离子方程式:.
(2)溶液D到沉淀E发生的离子方程式:。
(3)验证滤液B含Fe3+,可取少量滤液并加入。
(4)滤液K中溶质的主要成份是(填化学式)。
A、B、C、D都是中学化学常见的物质,其中A、B、C均含同一种元素。在一定条件下相互转化关系如下图所示(部分产物已略去)。请按要求回答下列问题:
(1)若B、C为氧化物,B转化为C时,质量增加25%,C能够与水反应生成一种强酸,则B转化为C的化学方程式是:。
(2)若D为某金属单质,向C的溶液中滴加硝酸银溶 液,产生不溶于稀硝酸的白色沉淀,则B的化学式是。
液,产生不溶于稀硝酸的白色沉淀,则B的化学式是。
(3)若D为强电解质溶液,A和C在溶液中反应生成白色沉淀B,则A和C反应的离子方程式是:。
符合条件的D物质可能是(填序号):
①硫酸②醋酸⑨氢氧化钠④一水合氨⑤氯化钡