(9分) 右图所示水槽中试管内有一枚铁钉,放置数天后观察:
(1)铁钉在逐渐生锈,则铁钉的 腐蚀属于 腐蚀。(填化学腐蚀或电化学腐蚀)
腐蚀属于 腐蚀。(填化学腐蚀或电化学腐蚀)
(2)若试管内液面上升,则原溶液呈 性,发生 腐蚀,正极反应式为 。
(3)若试管内液面下降,则原溶液呈 性,发生 腐蚀,正极反应式为 。
人类活动产生的CO2长期积累,威胁到生态环境,其减排问题受到全世界关注。
(1)工业上常用高浓度的K2CO3溶液吸收CO2,得溶液X,再利用电解法使K2CO3溶液再生,其装置示意图如下: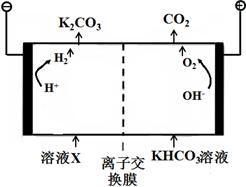
在阳极区发生的反应包括和H ++ HCO3-=H2O+CO2↑。
简述CO32-在阴极区再生的原理。
(2)再生装置中产生的CO2和H2在一定条件下反应生成甲醇等产物,工业上利用该反应合成甲醇。
已知:25 ℃,101 KPa下:
H2(g)+1/2 O2(g)=H2O(g) Δ H1=" -242" kJ/mol
CH3OH(g)+3/2 O2(g)=CO2 (g)+2 H2O(g) Δ H2=" -676" kJ/mol
写出CO2和H2生成气态甲醇等产物的热化学方程式。
下面表示合成甲醇的反应的能量变化示意图,其中正确的是(填字母序号)。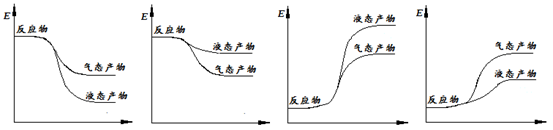
ab c d
(3)微生物燃料电池是一种利用微生物将化学能直接转化成电能的装置。已知某种甲醇
微生物燃料电池中,电解质溶液为酸性,示意图如下: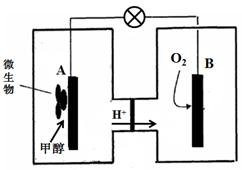
该电池外电路电子的流动方向为(填写“从A到B”或“从B到A”)。
工作结束后,B电极室溶液的pH与工作前相比将(填写“增大”、“减小”或“不变”,溶液体积变化忽略不计)。
A电极附近甲醇发生的电极反应式为。
硫酸工厂的烟气中含有SO2,有多种方法可实现烟气脱硫。
(1)工业制硫酸的过程中,SO2被氧气氧化的化学方程式为。
(2)“湿式吸收法”利用吸收剂与SO2发生反应从而脱硫。
已知:25℃时,H2SO3  HSO3 -+H+K=1.5×10-2
HSO3 -+H+K=1.5×10-2
H2CO3 HCO3 -+H+K=4.4×10-7
HCO3 -+H+K=4.4×10-7
下列试剂中适合用作该法吸收剂的是(填字母序号)。
a.石灰乳b. Na2SO3溶液c. Na2CO3溶液
②“钠碱法”用NaOH溶液作吸收剂,向100 mL 0.2 mol·L-1的NaOH溶液中通入标准状况下0.448 L SO2气体,反应后测得溶液pH<7,则溶液中下列各离子浓度关系正确的是(填字母序号)。
a.c(HSO3-)> c(SO32-)> c(H2SO3)
b.c(Na+)>c(HSO3-)> c(H+)> c(SO32-)
c.c(Na+)+c(H+)= c(HSO3-)+c(SO32-)+c(OH-)
(3)某硫酸厂拟用烟气处理含Cr2O72-的酸性废水,在脱硫的同时制备Cr2O3产品。具体流程如下: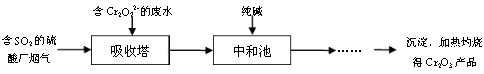
①吸收塔中反应后的铬元素以Cr3+形式存在,则其中发生反应的离子方程式为。
②中和池中的反应除生成Cr(OH)3沉淀外,还会产生某种气体,该气体的化学式为。
氨气在工农业生产中有重要应用。
(1)①氮气用于工业合成氨,写出氮气的电子式;
②NH3的稳定性比PH3(填写“强”或“弱”)。
(2)如下图所示,向NaOH固体上滴几滴浓氨水,迅速盖上盖,观察现象。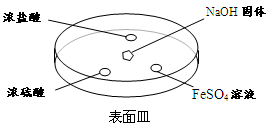
①浓盐酸液滴附近会出现白烟,发生反应的化学方程式为。
②浓硫酸液滴上方没有明显现象,一段时间后浓硫酸的液滴中有白色固体,该固体可能是(写化学式,一种即可)。
③FeSO4液滴中先出现灰绿色沉淀,过一段时间后变成红褐色,发生的反应包括
Fe2++2NH3·H2O=Fe(OH)2↓+ 2NH4+ 和。
(3)空气吹脱法是目前消除NH3对水体污染的重要方法。在一定条件下,向水体中加入适量NaOH可使NH3的脱除率增大,用平衡移动原理解释其原因。
(4)在微生物作用下,蛋白质在水中分解产生的氨能够被氧气氧化生成亚硝酸(HNO2),反应的化学方程式为,若反应中有0.3 mol电子发生转移时,生成亚硝酸的质量为g(小数点后保留两位有效数字)。
蓓萨罗丁是一种治疗顽固性皮肤T-细胞淋巴瘤的药物,有研究者设计其合成路线如下(部分反应试剂和条件已略):
已知:Ⅰ. 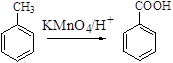 Ⅱ.
Ⅱ.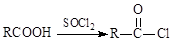
试回答下列问题:
(1)D的分子式为; F分子中含氧官能团的名称为、。
(2)原料A的结构简式为;原料B发生反应④所需的条件为。
(3)反应①、⑥所属的反应类型分别为、。
(4)反应②、⑤的化学方程式分别为②______________;⑤______________。
(5)对苯二甲酸有多种同分异构体,符合下列条件的同分异构体有种,写出其中任意一种的结构简式。
①苯环上有三个取代基;②能与NaHCO3溶液发生反应;③能发生银镜反应。
A、B两种有机物均是有机合成的中间体,其中A的分子式为C4H7O2Br,B分子中含2个氧原子,其燃烧产物n(CO2):n(H2O)=2:1,质谱图表明B的相对分子质量为188。A和B存在如下转化关系:
已知:①一个碳原子上连有两个羟基时,易发生下列转化:
②同一个碳原子上连有两个双键的结构不稳定。
请回答:
(1)C跟新制的氢氧化铜反应的化学方程式是。
(2)A的结构简式是。
(3)B的分子式是。
(4)F具有如下特点:①具有弱酸性;②核磁共振氢谱中显示五种吸收峰;③苯环上的一氯代物只有两种;④除苯环外,不含有其他环状结构。写出符合上述条件且具有稳定结构的任意两种同分异构体的结构简式:、。