下列离子方程式不正确的是
| A.过氧化钠和水反应:2O2- 2+2H2O=4OH-+O2↑ |
| B.向KI与稀硫酸的混合溶液中通入氧气:4H++O2+4I-=2I2+2H2O |
| C.足量的溴化亚铁和少量的氯气反应:2Fe2++Cl2=2Fe3++2Cl- |
| D.碳酸氢镁溶液中加入足量的澄清石灰水: |
Mg2++2HCO3-+2Ca2++4OH-=Mg(OH)2↓+2CaCO3↓+2H2O
下列根据实验操作和现象所得出的结论正确的是
| 选项 |
实验操作 |
实验现象 |
结 论 |
| A |
向某溶液中先加氯水再加KSCN溶液 |
溶液呈血红色 |
原溶液中定含Fe2+ |
| B |
向无色溶液中加盐酸酸化的BaCl2溶液 |
有白色沉淀 |
原溶液中定含SO42- |
| C |
向Na2SiO3溶液中通入适量CO2气体 |
出现白色胶状沉淀 |
碳的非金属性大于硅 |
| D |
用铂丝蘸取某物质的溶液进行焰色反应 |
火焰呈黄色 |
该物质定是钠盐 |
某有机物的结构简式如图所示,下列有关该物质的叙述错误的是
| A.分子式为C11H12O4 |
| B.苯环上的一氯代物有2种 |
| C.分子中所有的碳原子可能共平面 |
| D.能使酸性KMnO4溶液褪色 |
下列有关说法正确的是
| A.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 |
| B.将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀 |
C.恒温下,体积可变的密闭容器中发生反应2NO2 N2O4,向平衡体系中充入氩气,达到新平衡时,NO2的百分含量增大 N2O4,向平衡体系中充入氩气,达到新平衡时,NO2的百分含量增大 |
D.25℃时,将NH3•H2O稀溶液加水稀释,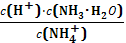 的值不变 的值不变 |
室温下,将1mol的CuSO4•5H2O(s)溶于水会使溶液温度降低,热效应为△H1,将1mol的CuSO4(s)溶于水会使溶液温度升高,热效应为△H2,CuSO4•5H2O受热分解的化学方程式为:CuSO4•5H2O(s)  CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是
CuSO4(s)+5H2O(l),热效应为△H3。则下列判断正确的是
| A.△H2>△H3 | B.△H1<△H3 | C.△H1+△H3=△H2 | D.△H1+△H2>△H3 |
甲~辛等元素在周期表中的相对位置如下表。甲与戊的原子序数相差3,戊的一种单质是自然界硬度最大的物质,丁与辛属同周期元素,下列判断正确的是
| A.金属性:甲>乙>丁 |
| B.原子半径:辛>戊>甲 |
| C.丙与庚的元素原子核外电子数相差13 |
| D.形成的最简单氢化物的稳定性:己>戊 |