下列有关说法正确的是
| A.2NO(g)+2CO(g)=N2(g)+2CO2(g)在常温下能自发进行,则该反应的△H>0 |
| B.将钢闸门与直流电源的正极相连,可防止钢闸门腐蚀 |
C.恒温下,体积可变的密闭容器中发生反应2NO2 N2O4,向平衡体系中充入氩气,达到新平衡时,NO2的百分含量增大 N2O4,向平衡体系中充入氩气,达到新平衡时,NO2的百分含量增大 |
D.25℃时,将NH3•H2O稀溶液加水稀释,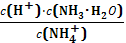 的值不变 的值不变 |
若过程I与过程II温度相同,则关于反应N2O4(g)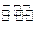 2NO2(g)在下列过程中发生的变化描述正确的是()
2NO2(g)在下列过程中发生的变化描述正确的是()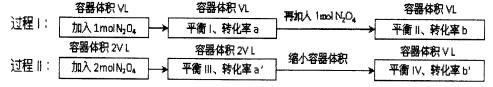
| A.a’<b’、a>b |
B.在平衡 I向平衡II过渡的过程中,v(逆)>v(正) I向平衡II过渡的过程中,v(逆)>v(正) |
| C.a’>a、b’<b |
| D.平衡II与平衡IV中N2O4的质量分数相等 |
A、B、C、D、E、F均为短周期元素,且原子序数依次增大,A是原子半径最小的元素,B的最高价氧化物的水化物可与其氢化物反应形成离子化合物甲;A与D可以按照原子个数比4:1形成化合物乙,且乙分子中含有18个电子,E与B同主族,C的阳离子与F的阴离予相差一个电子层,且可形成离子个数比为2:1的离子化合物丙。下列说法正确()
A.B的最高价氧化物对应水化物化学性质稳定
B.C、D、E、F原子半径由大到小的顺序为C>D>E>F
C.B、E形成的氢化物中,B的氢化物稳定性更强,是因为该分子中存在氢键
D.元素D、E、F的单质晶体属于同种类型的晶体
化学与生活、社会密切相关。下列叙述不正确的是()
| A.生产普通玻璃的主要原料及设备:石灰石、石英、纯碱及玻璃熔炉 |
| B.光导纤维导电能力很强,是一种很好的通讯材料 |
| C.制造生活中的水杯、奶瓶、食物保鲜膜等,使用聚乙烯材料比聚氯乙烯更有利于健康 |
| D.绿色荧光蛋白质(GFP)是高分子化合物,其水溶液有丁达尔效应 |
向一定量的Fe,FeO,Fe2O3,Fe3O4的混合溶液中,加入150mL 4mol/L的稀硝酸,恰好使混合物完全溶解,并放出标准状况下NO气体2.24L,往所得溶液中加KSCN溶液,无红色出现。若用一定量的氢气在加热条件下还原相同质量的该混合物,所得固体的物质的量可能为
| A.0.30 mol | B.028mol | C.0.25mol | D.0.22 mol |
常温下,用 0.1000 mol/LNaOH溶液逐滴加入到 20.00mL 0.1000 mol/LCH3COOH溶液所得滴定曲线如图。下列说法正确的是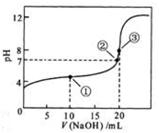
| A.点①的左端溶液可能存在:c(CH3COO-)+c(OH-)=c(CH3COOH)+c(H+) |
| B.①②之间(不含两点)所示溶液中:c(Na+)=c(CH3COOH)+ c(CH3COO-) |
| C.点③之后所示溶液中:c(CH3COOH)+c(H+)=c(OH-) |
| D.过程中可能出现:c(CH3COOH)>c(CH3COO-)>c(H+)>c(Na+)>c(OH-) |