写出下列化合物作为单体聚合生成的高分子化合物的结构简式:
(1)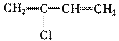 聚合得__________________________ _。
聚合得__________________________ _。
(2)已知 在虚线处开环聚合得
在虚线处开环聚合得 CH2CH2O
CH2CH2O n,则
n,则 开环聚合得_______________________________ 。
开环聚合得_______________________________ 。
天然气是一种洁净环保的优质能源,天然气主要成分是烷烃,其中甲烷占绝大多数。
(1)甲烷分子具有____________结构,其结构式是___________。
(2)天然气是一种高效、低耗、污染小的清洁能源,已知1mol甲烷完全燃烧生成CO2气体和水蒸气放出802KJ热量,则在相同条件下,1mol甲烷完全燃烧生成CO2气体和液态水,放出的热量________802KJ(填“>”、“=”或“<”)。
(3)通常情况下,甲烷比较稳定,但在特定条件下,甲烷也会发生某些反应,请写出甲烷在光照条件下与氯气反应生成一氯甲烷的化学方程式___________________该反应属于______________(填反应类型)。
(4)在一定条件下甲烷也可用于燃料电池。若以KOH溶液为电解质溶液,甲烷燃料电池正极的电极反应式为O2+4e-+2H2O=4OH-,则负极电极反应式为___________________;该电池工作过程中,溶液中OH-移向_____极。
把在空气中久置的铝片5.0 g投入盛有500 mL 0.5 mol·L-1硫酸溶液的烧杯中,该铝片与硫酸反应产生氢气的速率与反应时间的关系可用如图曲线来表示,回答下列问题:
(1)曲线由O →a段不产生氢气的原因是____________________________________________________________;
有关反应的化学方程式为
__________________________________________________;
(2)曲线a→c段,产生氢气的速率增加较快的主要原因是
________________________________________________________________________
________________________________________________________________________;
(3)曲线由c以后,产生氢气的速率逐渐下降的主要原因是_________________________;
(4)该反应若使用催化剂,可使H2产量增多吗?______(填“会”或“不会”)。
甲硅烷(SiH4)是一种无色气体,遇到空气能发生爆炸性自燃。
(1)甲硅烷中含有的化学键是_________ ,其在固态时属于______晶体。
(2)已知室温下1 g甲硅烷自燃生成SiO2和水放出热量44.6 kJ,则其热化学方程式为_________ 。
(14分)下表是元素周期表的短周期部分,表中字母分别表示一种元素。请回答下列问题:
| a |
|||||||
| b |
c |
d |
|||||
| e |
f |
g |
(1) f元素在周期表中的位置是第周期第族。
(2) e 与f两元素最高价氧化物的水化物相互反应的化学方程式为
_________________________________________________
(3)e在空气中燃烧的产物所含化学键的类型为__________、__________。
(4) 化合物ca3的电子式为,c和d两种元素氢化物的稳定性更强的是 _______(填物质的化学式)。
如图所示
(1)负极材料是,
(2)正极的电极反应式为,
(3)电池工作时总反应的离子方程式是
(4)电子的流向
(5)阳离子的移动方向___________________________