已知:

(式中X代表卤素原子)有以下反应,最终产物是乙二酸。
试 回答下列问题:
回答下列问题:
(1)C的结构简式是 ;
(2)B→C的反应类型是 ;
(3)E→F的化学方程式是 ;
(4)写出E与乙二酸发生酯化反应生成环状化合物的化学方程式
 ;
;
(5)写出E与乙二酸反应生成高分子化合物的化学方程式
;
(6)由B发生水解反应或C发生水化反应均生成化合物G。在乙二酸、水、苯酚、G四种分子中,羟基上氢原子的活泼性由强到弱的顺序是  。
。
(1)请将5种物质:N2O、FeSO4、Fe(NO3)3、HNO3和Fe2(SO4)3分别填入下面对应的横线上,组成一个未配平的化学方程式。
___________+___________ ___________+___________+___________+H2O
___________+___________+___________+H2O
(2)反应物中发生氧化反应的物质是___________,被还原的元素是___________。
(3)反应中1 mol氧化剂___________(填“得到”或“失去”) ___________mol电子。
(4)请将反应物的化学式及配平后的系数填入下列相应的位置中: ___________+
___________+ ___________
___________
新型纳米材料氧缺位铁酸盐(MFe2Ox,3<x<4,M=Mn、Co、Zn或Ni)由铁酸盐(MFe2O4)经高温还原而得,常温下,它能使工业废气中的酸性氧化物分解除去。转化流程如图所示:
(1)已知铁酸盐(MFe2O4)被H2高温还原时,发生反应的MFe2O4与H2的物质的量之比为2∶1,则还原产物MFe2Ox中x=________,MFe2Ox中+2价铁与+3价铁的物质的量之比为________。
(2)在酸性溶液中,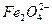 易转化为Fe2+:
易转化为Fe2+: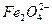 +2e-+8H+====2Fe2++4H2O,有KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式:_____________________________________。
+2e-+8H+====2Fe2++4H2O,有KMnO4、Na2CO3、Cu2O、Fe2(SO4)3四种物质中的一种能使上述还原过程发生,写出该氧化还原反应的离子方程式:_____________________________________。
(1)2008年9月25日,“神舟七号”载人航天飞船在酒泉卫星发射中心成功发射升空。航天飞船曾用金属铝粉和高氯酸铵混合物作为固体燃料。加热铝粉使其氧化并放出大量热量,促使混合物中另一种燃料分解。m mol高氯酸铵分解时除产生2m mol水蒸气和m mol氧气外,其他组成元素均以单质形式放出,因而产生巨大的推动力。
(1)写出其中涉及的化学方程式:_____________;____________。
(2)高氯酸铵作为火箭燃料的重要供氧剂。高氯酸铵在高压、450 ℃的条件下迅速分解生成水蒸气、氮气、氯化氢和氧气。
①写出此反应的化学方程式:____________________。
②反应中生成的氧化产物与还原产物的物质的量之比是__________,每分解1 mol高氯酸铵,转移的电子数目是__________。
在反应Fe2O3+3CO====2Fe+3CO2中,____________元素的化合价升高,该元素____________电子被____________,____________是还原剂, ____________表现还原性, ____________发生了氧化反应,氧化产物是____________;____________元素的化合价降低,该元素的原子____________电子,被____________,____________是氧化剂,表现了氧化性, ____________发生了还原反应,还原产物是____________。
配平方程式:
_________An+_________By-=_________Ax-+Bm