Ⅰ.玻璃棒是中学化学实验中常用的仪器。下列实验过程中,一般不需要用玻璃棒的是
(填写编号)
①用pH试纸测定Na2CO3溶液的pH; ②配制一定物质的量浓度的氯化钠溶液; ③将适量氯化铁饱和溶液滴入沸水中制备氢氧化铁胶体; ④探究Ba(OH)2 8H2O晶体和NH4Cl晶体反应过程中的能量变化; ⑤用蒸馏法分离两种沸点差距较大的液体; ⑥过滤分离互不相溶的固体和液体; ⑦用已知浓度的盐酸滴定待测浓度的NaOH溶液的酸碱中和滴定过程; ⑧稀释浓H2SO4的过程
8H2O晶体和NH4Cl晶体反应过程中的能量变化; ⑤用蒸馏法分离两种沸点差距较大的液体; ⑥过滤分离互不相溶的固体和液体; ⑦用已知浓度的盐酸滴定待测浓度的NaOH溶液的酸碱中和滴定过程; ⑧稀释浓H2SO4的过程
Ⅱ.为测定某含有杂质Na2O的Na2O2样品的纯度,某小组同学分别设计了如下方案。
【方案一】准确称量样品mg,与水充分反应后将溶液的体积稀释为VmL,从中取出V1mL溶液,装入锥形瓶,用已知浓度的盐酸进行滴定,以确定溶液的浓度,再计算出样品中Na2O2的含量。
(1)此方案中,酸碱中和滴定时应选用指示剂是 。
【方案二】准确称量样品mg,将样品与二氧化碳充分反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量。
(2)该方案的实验过程中,仪器的连接顺序是 (填仪器下方序号),①中的进气口为 (填“A”或“B”)
(3)装置⑤的作用是 。
(4)在可供选用的反应物只有CaCO3固体,6mol/L盐酸和蒸馏水时,请设计一种最简单的测定Na2O2纯度的实验方案 。
(1)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl、Cl2、H2SO4、H2O、KMnO4、MnSO4、K2SO4七种物质:
①该反应中,化合价升高的反应物是________,化合价没有发生变化的反应物是_______。
②写出一个包含上述七种物质的氧化还原反应方程式(不需配平)___________。
③上述反应中,氧化剂是________,1mol氧化剂在反应中________(填“得到”或“失去”)________mol电子。
④如果在反应后的溶液中加入NaBiO3,溶液又变紫红色。说出NaBiO3的一个性质:___________________________________________________________________。
(2)某反应体系中的物质有:NaOH、Au2O3、Na2S4O6、Na2S2O3、Au2O、H2O。
①将氧化剂与还原剂填入下列空格中,并标出电子转移的方向和数目。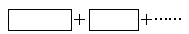
反应中,被还原的元素是________,氧化产物是______________。
②纺织工业中常用氯气作漂白剂,Na2S2O3可作为漂白布匹的“脱氯剂”,Na2S2O3和Cl2反应的产物是H2SO4、NaCl和HCl,则还原剂与氧化剂的物质的量之比为________。
(3)一定条件下,向废水中加入CH3OH,将HNO3还原成N2。若该反应消耗3.2 g CH3OH转移0.6 mol电子,则氧化产物为(填化学式),氧化产物与还原产物的物质的量之比是________。
有一包白色粉末,可能含有 Na2SO4、NaHCO3、KCl、Ba(OH)2、CuSO4中的一种或几种,按以下步骤进行实验:
①将此粉末溶于水,得到无色溶液和白色沉淀;
②将足量稀盐酸加入白色沉淀中,沉淀部分溶解,并有气泡产生。
⑴根据上述实验现象,判断此粉末中一定含有的物质是,一定没有的物质是(均填写化学式)。
⑵上述实验中第②步反应的离子方程式为:
有A、B、C、D四种溶液,它们是烧碱、硫酸、碳酸氢铵、氯化铜溶液中的某一种。各取少量,将其两两混合,其中A、B混合有蓝色絮状沉淀生成, C 与足量B或D混合均有无色气体产生。根据题意回答下列问题:
(1)B、C分别是、
(2)向A中滴加B,离子方程式:
向C中滴加D,离子方程式:
(3)少量B和C混合,现象:________,离子方程式:_______________________________。
(4)上述三个反应均属于________________反应(填基本反应类型),反应发生的条件的不同点是;相同点是。
(1)将ag氯化钙溶于1.8L水中,恰好使钙离子数与水分子数之比为1:100,则a值为 。
(2)在反应2A+B=3C+2D中,已知3.4gA与3.2gB完全反应,生成4.8gC,又知道D的式量为18,则B的式量是
(3)25.4g 某二价金属氯化物(ACl2)中含有0.4mol Cl-,则ACl2的摩尔质量是 ;A的相对原子质量是;ACl2的化学式是。
(4) 某混合物由Na2SO4、Al2(SO4)3组成,已知Na、Al两元素的质量之比为23: 9,则Na2SO4和Al2(SO4)3物质的量之比为,含1.00mol SO42–的该混合物的质量为。
常温下KMnO4氧化浓HCl的反应方程式如下:2KMnO4 +16HCl(浓)=2KCl+2MnCl 2+5Cl 2↑+8H2O
(1)用“双线桥法”标明反应中电子转移的方向和数目。
(2)又已知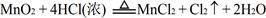 ,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:。
,结合以上反应原理,则MnO2、KMnO4、Cl2的氧化性由强到弱的顺序是:。
(3)若有63.2g高锰酸钾参加反应,则被氧化的HCl的物质的量为mol,产生的Cl2在标准状况下的体积为L。