下图是一个制取氯气并以氯气为原料进行某个特定反应研究的装置。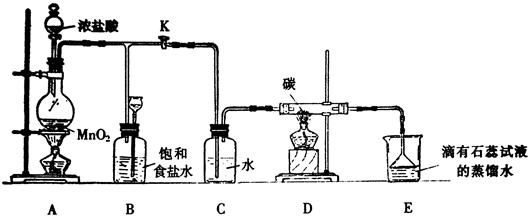
(1)实验开始时,先点燃A处的酒精灯,打开K,使Cl2充满整个装置,再点燃D处酒精灯,然后连接上E装置;E处石蕊试液先变红然后渐变为无色,同时漏斗中的液面略有上升,则产生颜色变化的原因是
a.反应中产生CO2的缘故 b.反应中产生HCl的缘故
c.反应中产生HCl并有Cl2溶于水 d.反应中同时有CO2、HCl产生的缘故
D处反应的化学方程式为 。
(2)装置C的作用是 。
(3)若将E处中的液体改为澄清石灰水,反应过程中的现象为 。
a.有白色沉淀产生 b.先生成白色沉淀而后沉淀消失
c.无明显现象 d.开始无沉淀,然后产生白色沉淀
(4)当反应结束后关闭K,移去A处酒精灯,由于余热作用,A处仍有Cl2产生,此时B中现象为 ,B的作用是  。
。
(5)E装置无法确认D处反应中有CO2产生,为了证明CO2的存在,要对E装置进行改变,下列装置符合要求的是 。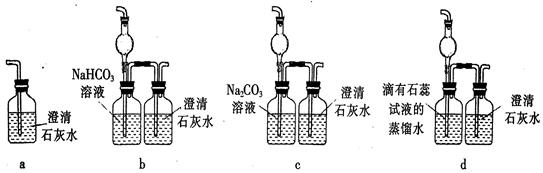
(6)本实验的目的是 。
为了验证镁和铝的金属性强弱,某同学欲设计实验验证。
提供的试剂有:镁带、铝条、水、盐酸、浓硫酸。
(1)所选试剂为_______________;
(2)发生反应的化学方程式为_______________;
(3)请简要叙述其操作过程及现象_______________。
将质量相等的锌片和铜片用导线相连浸入500mL硫酸铜溶液中构成如下图的装置。
(1)此装置为_______________,该装置中发生反应总的离子方程式为_______________,铜片周围溶液会出现_______________的现象。
(2)若2 min后测得锌片质量减少1.3g,则导线中流过的电子为_______________mo1。
(3)该装置的电解质溶液还可以用 _______________(答一种即可)。
下图中A~J均为中学化学中常见的物质,它们之间有如下转化关系。其中A、D为金属单质,B是一种红棕色固体。(反应过程中生成的水及其他产物已略去)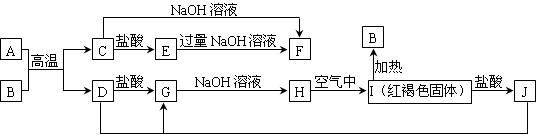
请回答以下问题:
(1)B是,H是,I是,F是。(填化学式)
(2)写出A和B的反应的化学方程式为。:
(3)写出J与D反应转化为G的离子方程式。
气体A的产量是衡量一个国家石油化工发展水平的标志,D是食醋中的主要成分。A能发生以下转化: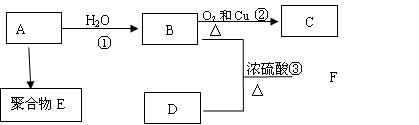
(1)A的结构简式为: 。
(2)E是(写结构简式);D中含官能团名称;
(3)写出相应转化过程的反应化学方程式
②: 反应类型: 反应
③:反应类型: 反应
用铜片、锌片和200mL稀H2SO4等组成原电池(如右图)。若整个实验过程有6.5 g锌溶解,此时H2SO4恰好全部用完。回答下列问题:
写出正极的电极反应式,正极发生的现象是,负极的电极反应式为。
(2)试计算:铜片上共放出L气体(标准状况),整个实验过程转移电子mol,稀硫酸的物质的量浓度为mol/L。