甲、乙两同学欲制取纯净的Fe(OH)2 ,根据如图所示的装置进行试验。A管中是Fe+H2SO4, B管中是NaOH溶液,请回答下列问题。
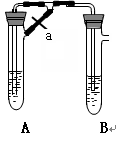
(1)同学甲:先夹紧止水夹a,使A管开始反应,在B管中观察到的现象是 。
(2)同学乙:打开a,使A管中反应一段时间再 夹紧止水夹a,实验中在B管中观察到的现象是 ,B中发生反应的离子方程式为
(3)同学乙打开a的目的 ; (填甲或乙)同学可成功。
火柴是人们常用的生活用品,某兴趣小组为验证日常生活用的火柴头上含有KClO3、MnO2、S等物质,设计了以下系列实验,并回答下列各题。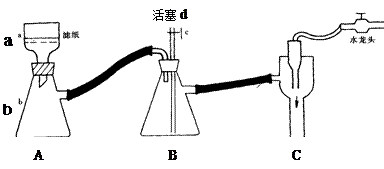
Ⅰ、火柴头中硫元素的实验证明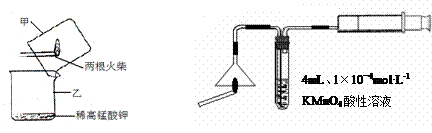
A B
⑴设计装置A中可观察到 的实验现象,即可证明火柴头上含有S元素。
⑵甲同学认为B装置中除了可选用稀高锰酸钾外还可选用:品红溶液、紫色石蕊溶液、滴有酚酞的NaOH溶液、溴水等,经大家分析后淘汰了紫色石蕊溶液和滴有酚酞的NaOH溶液。你认为淘汰的原因可能是 。甲同学还认为在A装置中选用浓的高锰酸钾酸性溶液更好,因为浓度越大反应速率越快,你认为对吗? (先判断再说明原因)。
Ⅱ、火柴头中含有Cl元素的证明,设计了以下实验流程图: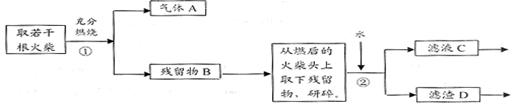
⑴为验证火柴头中含有Cl元素的实验步骤是:取滤液C……请回答后续实验步骤是 。
⑵有学生提出检验火柴头上KClO3另一套实验方案:
|
|
实验中发生的反应是 KClO3 + 3NaNO2 + AgNO3 = AgCl↓+ 3NaNO3 + KNO3,其中NaNO2 是 。剂,有人提出上述方法中出现白色沉淀并不能充分说明火柴头上 KClO3的存在,其理由是 。
Ⅲ、测定火柴头中KClO3的含量,设计了以下实验流程图:
已知:向一体积为2L的密闭容器中加入0.1mol碘单质和足量的钨,当温度为943K时存在:W(s)+I2(g)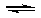 WI2(g)反应,反应达到平衡时碘单质的转化率为20%,
WI2(g)反应,反应达到平衡时碘单质的转化率为20%,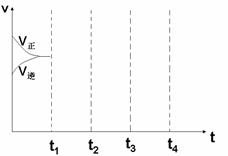
(1)求943K时此反应的平衡常数:K=_____________
(2)若起始时向此密闭容器中再加入0.1mol WI2达平衡,此时容器中各气体的体积比:___________,当同时加入等物质的量I2(g)和WI2(g),平衡___________方向移动(填正反应、逆反应或不移动)
⑶画出W(s) + I2(g) 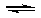 WI2(g) △H<0时间—速率图。一定温度过量W反应达平衡,到t1时降低温度,到t2时再加压,再到t3时加催化剂,到t4时加I2
WI2(g) △H<0时间—速率图。一定温度过量W反应达平衡,到t1时降低温度,到t2时再加压,再到t3时加催化剂,到t4时加I2
(4)一定温度下,向一容积不变的容器中加入足量钨和1molI2(g),使之反应: W(s) + I2(g) 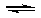 WI2(g) ΔH= —40.9KJ/mol,反应达平衡时气体平均摩尔质量增加 91.9g/mol,反应达平衡时放出的热量(已知钨的相对原子质量为183.8): ____________________.
WI2(g) ΔH= —40.9KJ/mol,反应达平衡时气体平均摩尔质量增加 91.9g/mol,反应达平衡时放出的热量(已知钨的相对原子质量为183.8): ____________________.
已知反应:
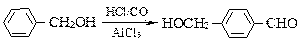 、
、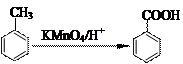
 现有物质A~I的转化关系如下图:
现有物质A~I的转化关系如下图:

 若B的分子式为C8H8O,其苯环上的一元取代物只有两种;G为高分子化合物。请回答下列问题:
若B的分子式为C8H8O,其苯环上的一元取代物只有两种;G为高分子化合物。请回答下列问题: (1)写出下列反应的反应类型:反应④,反应③。
(1)写出下列反应的反应类型:反应④,反应③。 (2)写出下列物质的结构简式:F,I,A。
(2)写出下列物质的结构简式:F,I,A。 (3)写出下列反应的化学方程式:
(3)写出下列反应的化学方程式: ①B→C:;
①B→C:; ②C+D→H:;
②C+D→H:; ③F→G:;
③F→G:; (4)C的同素分异构体且属于酯类的芳香族化合物共有种,请写出其中一种同分异构体的结构简式:。
(4)C的同素分异构体且属于酯类的芳香族化合物共有种,请写出其中一种同分异构体的结构简式:。
在一定温度下,把2 mol N2和6 mol H2通入一个体积不变的密闭容器中,(如右图):容器中发生以下的反应:
N2(g)+3 H2(g)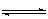 2NH3 (g)(正反应为放热反应)
2NH3 (g)(正反应为放热反应)
若反应达到平衡后,测得混和气体为7 mol ,据此回答下列问题:
保持上述反应温度不变,使a、b、c分别代表初始加入的N2、H2和NH3的物质的量,如果反应达到平衡后混和气体中各物质的物质的量分数仍与上述平衡时完全相同,那么:
(1)若a="1" mol ,c="2" mol ,则b="____" mol,在此情况下,反应起始时将向方向进行(填 “正”或“逆”)
(2)若规定起始时反应向逆反应方向进行,则c的范围是。
(3)在上述装置中,若需控制平衡后的混和气体的物质的量为6.5 mol,则可采取的措施是
A、B、C、D是四种常见单质,其对应元素的原子序数依次增大,其中B、D属于常见金属,其余均为常见化合物,J是一种黑色固体,I的浓溶液具有还原性,从A—I的所有物质之间有如下的转化关系:
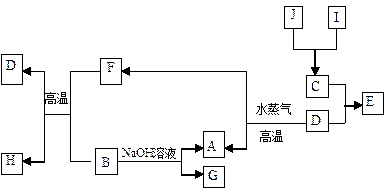
 (1)写出下列物质的名称A;G。
(1)写出下列物质的名称A;G。 (2)写出下列反应的化学方程式:
(2)写出下列反应的化学方程式: ①B+F→D+H:;
①B+F→D+H:; ②D→A+F:;
②D→A+F:; ③B→A+G:。
③B→A+G:。 (3)将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是
(3)将适量J加入酸化的H2O2的溶液中,J溶解生成它的+2价离子,该反应的离子方程式是 。
。