A、B、C、D四种短周期元素,其核电荷数依次增大,已知元素A和D可形成两种常温下均为液体的化合物,B原子最外层电子数是最内层电子数的两倍。则下列由四种元素形成的化合物的化学式或结构式不正确的是
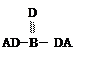 |
|||
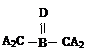 |
A.B2A6CD2 B. C. D.B2A5D2C
下列离子方程式书写正确的是
| A.铁片放入稀盐酸中:2Fe + 6H+ = 2Fe3+ + 3H2↑ |
| B.大理石放入稀硝酸中 CO32- + 2H+ = CO2↑+ H2O |
| C.铁片插入硫酸铜溶液2Fe + Cu2+ =" Cu" + 2Fe2+ |
| D.硫酸铜与氢氧化钡溶液反应:Cu2+ + SO42- + Ba2+ + 2OH- = Cu(OH)2↓+ BaSO4↓ |
下列电离方程式错误的是
| A.KNO3 = K+ + NO3- |
| B.NaHSO4 = Na+ + H+ + SO42- |
| C.BaCl2 = Ba2+ + Cl2- |
| D.Na2SO4 = 2Na+ + SO42- |
常温下,下列各组离子在指定溶液中一定能大量共存的是
| A.无色溶液中:Al3+、Cl—、MnO4—、SO42— |
| B.含有大量HCO3-的溶液中:Na+、Ca2+、NO3—、Cl— |
| C.0.1 mol·L-1AgNO3溶液:H+、K+、SO42—、Cl— |
| D.使石蕊变红色的溶液:CH3COO—、Cl—、NO3—、K+ |
标准状况下VL氨气溶解在1L水中(水的密度为1g/ml),所得溶液的密度为ρg/ml,质量分数为ω,物质的量浓度为c mol/L,则下列关系中不正确的是
A. |
B.ω |
C.ω |
| D.c=1000Vρ/(17V+22400) |
科学家刚刚发现了某种元素的原子,其质量是ag,12C的原子质量是bg,NA是阿伏加德罗常数的值,下列说法不正确的是
| A.该原子的摩尔质量是aNAg/mol |
B.Wg该原子的物质的量一定是 mol mol |
C.Wg该原子中含有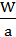 个该原子 个该原子 |
D.由已知信息可得:NA=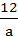 |