美国罗氏生产的奥司他韦磷酸盐胶囊剂(商品名中国大陆称达菲·港译特敏福,台湾译为克流感)是市场上唯一的奥司他韦制剂。2009的,由于甲型H1N1在世界范围的扩散,全球掀起一般抢购达菲原风潮。奥司他韦的结构如图;下列说法正确的是
| A.奥司他志是一种芳香族化合物,分子式为C18H28O4N3 |
| B.1mol该化合物可以和3mol氢气发生加成反应 |
| C.该化合物能发生水解反应,加成反应、氧化反应和消去反应 |
| D.奥司他韦可以和磷酸在一定条件下制取奥司他韦磷酸盐是由于具有碱性基团氨基 |
在t℃下,某反应达到平衡,平衡常数K=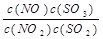 。恒容时,温度升高,NO浓度减小。下列说法正确的是
。恒容时,温度升高,NO浓度减小。下列说法正确的是
| A.该反应的焓变为正值 |
| B.K表达式中,C(SO3)指反应在该条件下达到化学平衡时SO3的物质的量浓度 |
| C.升高温度,逆反应速率减小 |
D.该反应化学方程式为:NO+SO3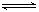 NO2+SO2 NO2+SO2 |
某溶液中只含有Na+、H+、OH-、A-四种离子,下列说法正确的是
A.若c(OH-)>c(H+),溶液中不可能存在:c(Na+)>c(OH-)>c(A-)>c(H+)
B.溶液中不可能存在:c(Na+)>c(A-)>c(OH-)>c(H+)
C.若溶液中c(A-)=c(Na+),则溶液一定呈中性
D.若溶质为NaA、HA,则一定存在:c(A-)>c(Na+)>c(H+)>c(OH-)
某同学设计如下实验测量m g铜银合金样品中铜的质量分数:
下列说法中不正确的是
| A.收集到的V L气体全为 NO |
| B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒 |
| C.操作Ⅱ应是洗涤 |
D.铜的质量分数为: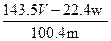 ×100% ×100% |
已知X、Y、Z、W四种短周期主族元素在周期表中的相对位置如图所示。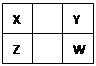
下列说法正确的是
| A.Z元素的原子半径可能比Y元素的小 |
| B.Z元素的最高化合价可能比Y元素的高 |
| C.W的气态氢化物的稳定性一定比Y的强 |
| D.Z的最高价氧化物的水化物的酸性一定比W的强 |
下列除去杂质的方法正确的是
A.除去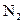 中的少量 中的少量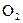 :通过灼热的CuO粉末,收集气体 :通过灼热的CuO粉末,收集气体 |
B.除去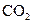 中的少量HCl:通入 中的少量HCl:通入 溶液,收集气体 溶液,收集气体 |
C.除去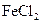 溶液中的少量 溶液中的少量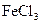 :加入足量铁屑,充分反应后,过滤 :加入足量铁屑,充分反应后,过滤 |
D.除去KCl溶液中的少量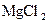 :加入适量NaOH溶液,过滤 :加入适量NaOH溶液,过滤 |