某同学设计如下实验测量m g铜银合金样品中铜的质量分数:
下列说法中不正确的是
| A.收集到的V L气体全为 NO |
| B.过滤用到的玻璃仪器是:烧杯、漏斗、玻璃棒 |
| C.操作Ⅱ应是洗涤 |
D.铜的质量分数为: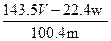 ×100% ×100% |
下列实验事实不能用平衡移动原理解释的是( )。
A. |
B. |
C. |
D.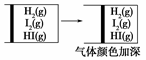 |
一定条件下,在体积为10 L的固定容器中发生反应:N2(g)+3H2(g) 2NH3(g) ΔH<0,反应过程如图:
2NH3(g) ΔH<0,反应过程如图:
下列说法正确的是( )。
| A.t1 min时正、逆反应速率相等 |
| B.X曲线表示NH3的物质的量随时间变化的关系 |
C.0~8 min,H2的平均反应速率v(H2)=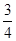 mol·L-1·min-1 mol·L-1·min-1 |
| D.10~12 min,升高温度使反应速率加快,平衡正向移动 |
下图是N2与H2反应生成NH3的过程中能量变化的曲线图: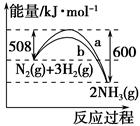
下列叙述正确的是( )。
| A.该反应的热化学方程式为N2(g)+3H2(g)=2NH3(g) ΔH=-92 kJ |
| B.b曲线是加入催化剂时的能量变化曲线 |
| C.加入催化剂,该化学反应的反应热减小 |
| D.在温度、体积一定的条件下,通入1 mol N2和3 mol H2反应后放出的热量为Q1 kJ,若通入2 mol N2和6 mol H2反应后放出的热量为Q2 kJ,则184>Q2>2Q1 |
化学反应中的能量变化是由化学反应中旧化学键断裂时吸收的能量与新化学键形成时放出的能量不同引起的。如下图为N2(g)和O2(g)反应生成NO(g)过程中的能量变化: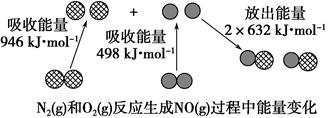
下列说法正确的是( )。
| A.1 mol N2(g)和1 mol O2(g)反应吸收的能量为180 kJ |
| B.1 mol N2(g)和1 mol O2(g)具有的总能量小于2 mol NO(g)具有的总能量 |
| C.通常情况下,N2(g)和O2(g)混合能直接生成NO |
| D.NO是一种酸性氧化物,能与NaOH溶液反应生成盐和水 |
在同温同压下,下列各组热化学方程式中ΔH1>ΔH2的是( )。
| A.2H2(g)+O2(g)=2H2O(l) ΔH1 2H2(g)+O2(g)=2H2O(g) ΔH2 |
| B.S(g)+O2(g)=2SO2(g) ΔH1S(s)+O2(g)=2SO2(g) ΔH2 |
C.C(s)+ O2(g)=CO(g) ΔH1 C(s)+O2(g)=CO2(g) ΔH2 O2(g)=CO(g) ΔH1 C(s)+O2(g)=CO2(g) ΔH2 |
D.H2(g)+Cl2(g)=2HCl(g) ΔH1 H2(g)+ H2(g)+ Cl2(g)=HCl(g) ΔH2 Cl2(g)=HCl(g) ΔH2 |