把0.1mol铝投入到。 100mL3mol/L的.NaOH溶液中充分反应后,再滴人lmol/L的H2SO4120mL,其结果( )
100mL3mol/L的.NaOH溶液中充分反应后,再滴人lmol/L的H2SO4120mL,其结果( )
| A.溶液的pH<7 | B.得到澄清透明溶液 |
| C.有沉淀生成 | D.先有白色沉淀生成,后逐渐溶解 |
m molC2H2和n molH2在密闭容器中反应,当其达到平衡时,生成p molC2H4。将平衡混合气体完全燃烧生成CO2和H2O,所需O2的物质的量是
A.3m+nmol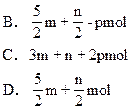
把三氯化铁溶液蒸干灼烧,最后得到的固体产物是
| A.无水三氯化铁 |
| B.氢氧化铁 |
| C.氧化亚铁 |
| D.三氧化二铁 |
下列实验能达到预期目的的是 [ ]
| A.取加热至亮棕色的纤维素水解液少许,滴入新制的氢氧化铜溶液,加热有红色沉淀物生成,证明水解产物为葡萄糖 |
| B.利用FeCl3溶液鉴别苯酚溶液和甲醇溶液 |
| C.利用能否与乙醇发生酯化反应鉴别乙酸和硝酸 |
| D.经唾液充分作用后的苹果中滴入碘水会显蓝色 |
A、B是短周期元素,两者形成化合物A2B3,若B的原子序数为a,则A的原子序数不可能为
A.a+8
B.a-3
C.a-11
D.a+5
从某些性质看,NH3与H2O相当,NH4+与H3O+相当,NH2-与OH-相当,NH2-与O2-相当。下列有关化学方程式不正确的是
| A.氯化铵与KNH2反应:NH4Cl+KNH2=KCl+2NH3 |
| B.二价活泼金属M与液氨反应:M+2NH3=M(NH2)2+H2↑ |
| C.盐酸与MNH反应:2HCl+MNH=MCl2+NH3 |
| D.氯化铵与MO反应:2NH4Cl+MO=M(NH2)2+2HCl+H2O |