氮的氧化物(用NOx表示)是大气污染物,必须加以处理。
(1)汽车尾气中的CO、NOx采用催化转化法处理,使它们相互反应生成参与大气循环的无毒气体。反应化学方程式可表示为:_ _____________。
_____________。
(2)工业尾气中氮的氧化物常采用氨催化吸收法,原理是NH3和NOx反应生成无毒的物质。某同学采用以下装置(见下图)和步骤模拟工业上氮的氧化物处理过程。
Ⅰ.提供的装置。
Ⅱ.NH3的制取。
①所提供的装置中能快速、简便制取NH3的装置是:__________(填仪器序号)。
②若采用C装置制取氨气(控制实验条件相同),情况如表所示。
实验记录
| 试剂组合序号 |
固体试剂/g |
NH3体积/mL |
| a |
12.0g Ca(OH)2(过量) 10.8g NH4Cl |
2688 |
| b |
12.0g Ca (OH)2(过量) 10.8g(NH4)2SO4 (OH)2(过量) 10.8g(NH4)2SO4 |
2728 |
| c |
12.0g NaOH(过量) 10.8g NH4Cl |
3136 |
| d |
12.0g NaOH(过量) 10.8g (NH4)2SO4 |
3118 |
| e |
12.0g CaO(过量) 10.8g NH4Cl |
3506 |
| f |
12.0g CaO(过量) 10.8g (NH4)2SO4 |
3584 |
分析表中数据,实验室制NH3产率最高的是:___________________(填序号),其他组合NH3产率不高的原因是:____________。
Ⅲ.模拟尾气的处理。
选用上述部分装置,按下列顺序连接成模拟尾气处理装置:
①A中反应的离子方程式:_________。
②D装置作用除使气体混合均匀和调节气流速度以外,还有一个作用是_____________。
③D装置中的液体可换成_________(填序号)。
a.CuSO4溶液 b.H2O c.CCl4 d.浓H2SO4
④该同学所设计的模拟尾气处理实验还存在的明显缺陷是____ ____________。
____________。
氮及其化合物与人类各方面有着密切的联系。Ⅰ现有一支15mL的试管,充满NO倒置于水槽中,向试管中缓缓通入一定量氧气,当试管内液面稳定时,剩余气体3mL。则通入氧气的体积可能为mL。
Ⅱ目前,消除氮氧化物污染有多种方法。
(1)用CH4催化还原氮氧化物可以消除氮氧化物的污染。已知:
①CH4(g)+4NO2(g)= 4NO(g)+CO2(g)+2H2O(g) △H="-574kJ/mol"
②CH4(g)+4NO(g)= 2N2(g)+CO2(g)+2H2O(g) △H="-1160kJ/mol"
③H2O(g)= H2O(l)△H=-44kJ/mol
写出CH4(g)与NO2(g)反应生成N2(g)、CO2(g)和H2O(l)的热化学方程式。
(2)用活性炭还原法处理氮氧化物,有关反应为:
某研究小组向恒容密闭容器加入一定量的活性炭和NO,恒温(T0C)条件下反应,反应进行到不同时间测得各物质的浓度如下: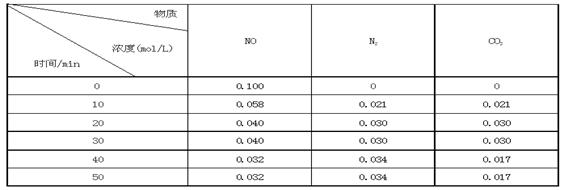
①不能作为判断反应达到化学平衡状态的依据是_______;(选填字母代号)
A.容器内CO2的浓度保持不变
B.v正(N2)="2" v正(NO)
C.容器内压强保持不变
D.混合气体的密度保持不变
E.混合气体的平均相对分子质量保持不变
②前20分钟,平均反应速率v(NO)=。v(NO)=(0.1- 0.04)/ 20 = 0.003mol·L-1· min-1
③在T0C时,该反应的平衡常数为_______(保留两位小数);
④在30min,改变某一条件反应重新达到平衡,则改变的条件是_______。
(3)科学家正在研究利用催化技术将超音速飞机尾气中的NO和CO转变成CO2和N2,其反应为: 
研究表明:在使用等质量催化剂时,增大催化剂的比表面积可提高化学反应速率。为了分别验证温度、催化剂的比表面积对化学反应速率的影响规律,某同学设计了三组实验,部分实验条件已经填在下表中。
| 实验编号 |
T(0C) |
NO初始浓度 (mol/L) |
CO初始浓度 (mol/L) |
催化剂的比 表面积(m2/g) |
| Ⅰ |
280 |
1.20×10-3 |
5.80×10-3 |
82 |
| Ⅱ |
a |
b |
c |
124 |
| Ⅲ |
350 |
d |
e |
124 |
上表中:a=_______,b=________,e=________。
从辉铜矿(Cu2S)中利用火法炼铜可以提取铜,发生如下反应: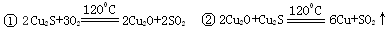
下面是由Cu2S冶炼铜及制取CuSO4·5H2O的流程图:
⑴Cu2S中铜元素的化合价为,当有1molCu2S与O2反应生成2molCu时,转移电子的物质的量是。
⑵Cu2O、CuO中加入足量稀硫酸得到的体系A中看到溶液呈蓝色,且有红色物质生成,请写出生成红色物质的离子方程式。
⑶若使A中单质溶解,操作Ⅰ中加入的试剂最好是。(选填字母代号)
A.适量的HNO3 B.适量的NaOH C.适量的H2O2
该反应的离子方程式为。
⑷取5.00g胆矾样品逐渐升高温度使其分解,分解过程的热重曲线(样品质量随温度变化的曲线)如下图所示:
①由图中可以看出,胆矾分解的最低温度是。
②通过计算确定258℃时发生反应的化学方程式为,e点对应的化学式为(计算过程略去)。
PTT是近几年来迅速发展起来的新型热塑性聚酯材料,具有优异性能,能作为工程塑料,纺织纤维和地毯等材料而得到广泛应用.其合成路线可设计为:
其中A,B,C均为链状化合物,A ,B均能发生银镜反应,C中不含甲基,1mol C可与足量钠反应生成22.4 L H2 (标准状况).
请回答下列问题:
(1)A中所含官能团的名称为,B的结构简式为.
(2)由物质C与D反应生成PTT的化学方程式为,反应类型为.
(3)分子式为C4H6O,与A互为同系物的同分异构体有种.
(4)请补充完整下列以CH2=CHCH3为主要原料(无机试剂任用)制备CH3CH(OH)COOH的合成路线流程图(须注明反应条件).
金属镍,铁及非金属元素碳在合金材料,有机合成材料中有广泛的应用.请回答下列问题:
(1)Ni原子的核外电子排布式为.
(2)Fe原子的外围电子排布图为.
(3)含碳化合物丙烯腈(H2C=CH—C≡N)分子中碳原子轨道杂化类型为
(4)NiO,FeO的晶体类型均与氯化钠晶体相同,Ni2+和Fe2+离子半径分别为69 Pm和78 Pm,则两种物质的熔点
NiOFeO(填“>”或“<”),判断依据是.
(5)CaC2晶体的晶胞也与氯化钠相似,但由于CaC2晶体中的C22-存在,使晶胞沿一个方向拉长,则CaC2晶体中1个C22-周围距离最近且相等的Ca2+数目为,C22-与O22+互为等电子体,写出O22+的电子式.
(6)铁在一定条件下可形成体心立方堆积的晶体,设铁原子半径为r,请用含r的代数式表示该晶体空间利用率.
亚氯酸钠(NaC1O2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖,油脂的漂白与杀菌.以下是过氧化氢法生产亚氯酸钠的工艺流程图: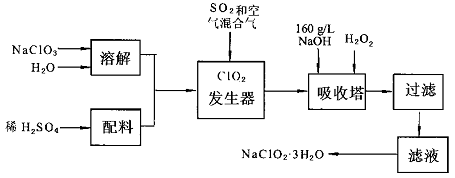
已知:①NaC1O2的溶解度随温度升高而增大,适当条件下可结晶析出NaC1O2·3H2O.
②纯C1O2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全.
I.请根据上述流程回答下列问题
(1)发生器中鼓入空气的作用可能是
(2)吸收塔内的反应的化学方程式为.吸收塔的温度不能超过20℃,其目的是.
(3)在碱性溶液中NaC1O2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是.
(4)从滤液中得到NaC1O2·3H2O粗晶体的实验操作依次是.
II.上述流程中的原料NaC1O3可由氯气通入热的烧碱溶液后重结晶就得到比较纯净的产品,所以通常工厂联合氯碱车间制备.
(1)氯碱工业中的原料为,原料需要净化的原因是,阳极产品为
(2)工业生产NaC1O3的化学方程式为