化学反应终点的判断是化学定量实验的重要环节,下列对化学反应终点的判断不正确的是 ( )
| A.向BaCl2溶液中加入适量Na2CO3溶液后,静置,向上层清液中继续滴加Na2CO3溶 液,若无沉淀,说明Ba2+已经完全沉淀 |
| B.淀粉在稀硫酸的作用下水解后,加NaOH溶液使溶液呈碱性,加入新制Cu(OH)2,加热,若有红色沉淀生成,说明淀粉已经完全水解 |
| C.将Na2SO4·10H2O晶体置于坩埚中加热,冷却后称量,并重复上述操作,若相邻两次称量的结果相同,说明硫酸钠已全部失去结晶水 |
| D.用酸式滴定管向滴有酚酞的NaOH溶液中滴加标准HCl溶液,若滴入最后一滴HCl溶液后粉红色刚好褪去,说明已达滴定终点 |
物质的量浓度相同的下列溶液中,NH4+浓度最大的是()
| A.NH4Cl | B.NH4HSO4 | C.CH3COONH4 | D.NH4HCO3 |
有些固体药品长期存放时,若因密封不严,瓶内会逐渐积聚一定量的液体.以下各组中的每种药品都可能会出现这种现象的是()
| A.硫磺、生石灰、无水硫酸铜 | B.红磷、氯化铁晶体、无水硝酸镁 |
| C.白磷、明矾、无水氯化镁 | D.碘片、氯化钠、无水氯化钙 |
下列方程式的书写或描述正确的是()
| A.用碳酸钠溶液浸泡锅炉水垢:CaSO4+CO32-CaCO3↓+SO42- |
B.热化学方程式C2H2(g)+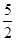 O2(g)2CO2(g)+H2O(g);△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol O2(g)2CO2(g)+H2O(g);△H=-1256kJ/mol,表示乙炔的燃烧热为1256kJ/mol |
C.铂电极电解MgCl2饱和溶液: |
| D.H+(aq)+OH(aq)H2O(1);△H=-57.3 kJ/mol,表示含1 mol NaOH的氢氧化钠溶液与含0.5 mol H2SO4的浓硫酸混合后放出57.3 kJ的热量 |
常温下,下列各组离子在指定溶液中一定能大量共存的是()
| A.1.0 mol·L-1的KNO3溶液中:Na+、Fe2+、Cl-、SO42- |
| B.加入铝粉放出H2的溶液中:Al3+、K+、SO42—、Cl— |
| C.在含大量Fe3+的溶液中:NH4+、Na+、Cl—、SCN— |
| D.水电离产生的c(OH—)=10—12 mol·L—1的溶液中:K+、Mg2+、SO42—、NO3— |
实验室用足量镁粉与一定量的某浓度的盐酸反应来制得氢气。由于反应速率太快,不易操作。为减慢反应速率,同时又不影响生成H2的总量,可向盐酸中加入的物质是()
| A.CH3COONa固体 | B.NaOH溶液 |
| C.(NH4)2SO4粉末 | D.K2SO4固体 |