目前世界上比较先进的电解制碱技术是离子交换膜法。
(1)在离子交换膜法电解饱和食盐水过程中,与电源正极相联的电极上所发生反应为__________,与电源负极相连的电极附近溶液的pH__________(选填“不变”“升高”“降低”)。
(2)如果粗盐中SO42-含量较高,必须添加试剂除去SO42-,则按添加试剂顺序,依次发生反应的离子方程式为______________________________。
(3)在电解制得的NaOH中往往还含有一定量的NaCl,因此必需进行脱盐工序,脱盐工序中利用NaOH和NaCl在溶解度上的差异,通过__________.冷却.__________(填写操作名称)除去NaCl。
(4)现有阳离子交换膜.阴离子交换膜.石墨电极和如下图所示电解槽,用氯碱工业中的离子交换膜技术原理,可通过电解电解饱和Na2SO4溶液的方法生产NaOH溶液和H2SO4溶液.则电极c为__________极(填“正”.“负”.“阴”.“阳”),b为__________离子交换膜(填“阴”.“阳”)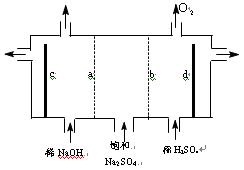
A—J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。
回答下列问题:
(1)B中的化学键有, E的电子式。
(2)写出反应⑦的离子方程式 __________________________。
(3)上述七个反应中属于氧化还原反应的是_____________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_____________(填“阴或阳”)极附近溶液由无色变为红色,其原因是。
.目前世界上60%的镁是从海水提取的。海水提镁的主要流程如下:
请回答下列问题:
(1)从离子反应的角度思考,写出在沉淀池的离子方程式。
(2)操作A是,操作B是。
(3)加入的足量试剂a是(填化学式)。
(4)无水MgCl2在熔融状态下,通电后会产生Mg和Cl2,该反应的化学方程式为。
(5)有同学认为:可直接加热Mg(OH)2得到MgO,再电解熔融MgO制金属镁,这样可简化实验步骤,体现实验的简约性原则。你 (填“同意”或“不同意”)此观点。
.现有反应:mA(g)+nB(g)  pC(g),达到平衡后,当升高温度时,混合体系中C的质量分数减小;当减小压强时,A的转化率变大,则:
pC(g),达到平衡后,当升高温度时,混合体系中C的质量分数减小;当减小压强时,A的转化率变大,则:
(1)该反应的逆反应为__________热反应,且m+n________p(填“>”、“=”或“<”)。
(2)加压时,B的质量分数________(填“增大”、“减小”或“不变”,下同)。B的转化率________
(3) 若C是有色物质,A、B均无色,则加入A(体积不变)时混合物颜色________;而保持容器体积不变,充入氖气时,混合物颜色________(填“变深”、“变浅”或“不变”)。
.2CO(g)+O2(g) 2CO2(g)反应过程的能量变化如图所示。已知1 mol CO (g)氧化为1 mol CO2 (g)的ΔH =-283 kJ/mol。请回答下列问题:
2CO2(g)反应过程的能量变化如图所示。已知1 mol CO (g)氧化为1 mol CO2 (g)的ΔH =-283 kJ/mol。请回答下列问题:
(1)图中A点表示:____________________________________;E的大小对该反应的反应热________(填“有”或“无”)影响。
(2)图中ΔH = ________kJ/mol。
.在200℃时,将a mol H2(g)和b mol Br2(g)充入到体积为1 L的密闭容器中,发生反应:Br2(g)+H2(g)  2HBr(g)。
2HBr(g)。
(1)反应刚开始时,由于c(H2)=________________,而c(HBr)=______,所以v正最大,而v逆最小为零;
(2)随着反应的进行,反应混合物中各组分浓度的变化趋势为c(Br2)______,
而c(HBr)__________,从而化学反应速率v正____________,而v逆________;(填“增大”、“减小”或“不变”)
(3)当反应进行到v正与v逆________时,此可逆反应就达到了平衡,若保持外界条件不变时,反应混合物中各组分百分含量都将________。
(4)保持容器内气体压强不变,向其中加入a mol H2(g)和b mol Br2(g),反应速率_______(填“增大”、“减小”或“不变”)理由是_______________