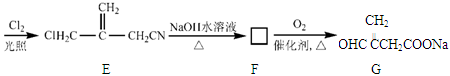
A—J是中学化学中常见的几种物质,它们之间的转化关系如图所示。已知常温下A为固体单质,B为淡黄色粉末,C、F、I为气态单质,E在常温下为液体,且E可由C、F合成,J可用作杀菌消毒剂。
回答下列问题:
(1)B中的化学键有 , E的电子式 。
(2)写出反应⑦的离子方程式 __________________________。
(3)上述七个反应中属于氧化还原反应的是_____________________。
(4)以Pt为电极电解滴加有少量酚酞的H饱和溶液,则在_____________(填“阴或阳”)极附近溶液由无色变为红色,其原因是 。
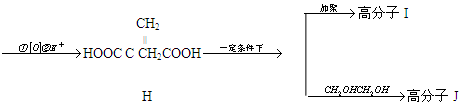
增塑剂是一种增加材料的柔软性或使材料液化的添加剂,不能用于食品、酒类等行业。DBP是增塑剂的一种,可由下列路线合成。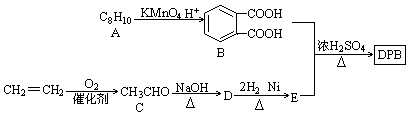
已知以下信息:
①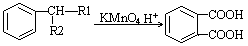
②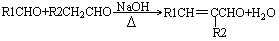
(—R1、一R2表示氢原子或烃基)
(1)A的结构简式,D→E的反应类型。
(2)B的名称是,D中含有的官能团名称是。
(3)由B和E合成DBP的化学方程式。
(4)写出同时符合下列条件的B的所有同分异构体结构简式
①能和NaHCO3溶液反应生成CO2③能使FeC13溶液发生显色反应
②能发生银镜反应④苯环上含碳基团处于对位
X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:
| 元素 |
相关信息 |
| X |
X的某种氢化物能使湿润的红色石蕊试纸变蓝 |
| Y |
单质是良好的半导体材料,广泛应用于光电信息领域 |
| Z |
Z的一种核素质量数为27,中子数为14 |
| W |
最高价氧化物对应的水化物是一种不溶于水的蓝色固体 |
(1)Z位于元素周期表第周期第族,W基态原子的核外电子排布式为
(2)X的第一电离能比Y的(填“大”或“小”),X的单质分子中σ键和π键的数目比为,Y氧化物属于晶体。
(3)X的氢化物(X2H4)的制备方法之一是将NaC1O溶液和XH3反应制得,试写出该反应的化学方程式。
(4)己知下列数据:
4W(s)+O2(g)=2W2O(s)△H=一337.2kJ·mol—1
2W(s)+O2(g)=2WO(s)△H=一314.6kJ·mol—1
由W2O和O2反应生成WO的热化学方程式是。
衣康酸H是制备高效除臭剂,粘合剂等多种精细化工的重要原料,可经下列反应路线得到(部分反应条件略)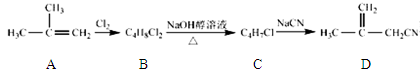
已知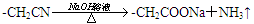
(1) C→D的反应类型是,B→C所加的试剂是,H→I发生反应的官能团的名称叫
(2) J的结构简式为
(3) H不能发生的化学反应是(选填序号)
a.取代反应 b.加成反应 c.氧化反应 d.消去反应
(4) E→F反应的化学方程式
(5) H的同分异物体M具有如下的性质:①M不能使溴的CCl4溶液褪色;②1 molM 最多可以与2mol NaOH反应;③1 mol M与足量的NaHCO3反应可生成1mol CO2,则M的结构简式为(写出一种)
(14分)工业制硝酸的主要反应是4NH3(g)+5O2(g)  4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
4NO(g)+6H2O(g)ΔH=-akJ/mol(a﹥0)
(1)如果将4molNH3和5molO2放入容器中,达到平衡时,放出热量0.8akJ,则反应时转移的电子数为
mol
(2)若其他条件不变,下列关系图中错误的是(选填序号)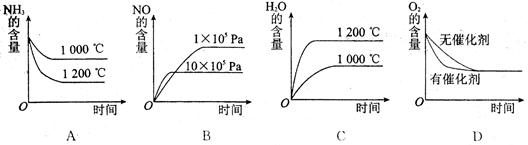
(3)t℃时,在容积固定的密闭容器中发生上述反应,容器内各物质的浓度如下表
| 浓度(mol/L) 时间(min) |
c(NH3) |
c(O2) |
c(NO) |
c(H2O) |
| 起始 |
4.0 |
5.5 |
0 |
0 |
| 第2min |
3.2 |
x |
0.8 |
1.2 |
| 第4min |
2.0 |
3.0 |
2.0 |
3.0 |
| 第6min |
2.0 |
3.0 |
2.0 |
3.0 |
①反应在第2mim到第4mim时,反应速率v(O2)=
②第2min时改变了条件,改变的条件可能是
A.升高温度 B.使用了催化剂 C.减小压强 D.增加了生成物
③在相同的温度下,起始向容器中加入NH3、O2、NO和H2O(g)的浓度都为1mol/L,则该反应将向 _______方向进行(填“正反应”.“逆反应”.“不移动”)
(4)工业上用水吸收二氧化氮生产硝酸,生成的NO2气体经过多次氧化、吸收的循环操作使其充分转化为硝酸(假定上述过程中无其它损失),现有23吨NO2经过2次氧化吸收得到20℅的稀硝酸吨。
(5)成品硝酸的浓度为60%~70%,为了制浓硝酸,常用Mg(NO3)2作吸水剂,然后进行蒸馏,不用CaCl2或MgCl2作吸水剂的原因是__________________________________________
A、B、C、D、E五种短周期元素,原子序数依次增大,A原子的最外层电子排布式为nsnnpn+1,C、D原子核外都有一个未成对电子,又知B和E为同一主族,C、D、E为同周期,且B、E的原子序数之和等于C、D的原子序数之和
(1) E离子的基态电子排布式 _______________
(2)元素B、C、D、E的原子半径从大到小的顺序是________(用元素符号填写,下同)
(3)元素A、B、C、D的第一电离能从大到小的顺序是
(4)写出C单质与B单质加热时生成的化合物的电子式
(5) D元素在周期表中的位置是_______________,中学化学实验室中制取D的最高价氧化物对应的水化物的离子方程式为___________________________________
(6)已知:①A2(g)+B2(g)=2AB(g)ΔH1=akJ/mol
②2AB(g)+B2(g)=2AB2(g)ΔH2=bkJ/mol
③AB(g)+AB2(g)= A2B3(g)ΔH3=ckJ/mol
则2A2(g)+3B2(g)=2A2B3(g)ΔH=kJ/mol (用a.b.c表示)