TiO2在工业生产和日常生活中有重要用途。
I.工业上用钛矿石(FeTiO3,含FeO、Al2O3、SiO2等杂质)经过下述反应制得:
其中,步骤②发生的反应为:2H2SO4+FeTiO3=TiOSO4+FeSO4+2H2O。
(1)净化钛矿石时,是否需要除去杂质FeO?答: (填“需要”或“不需要”)。
(2)净化钛矿石时,需用浓氢氧化钠溶液来处理,写出该过程中发生反应的化学方程式。
答: 。
II.TiO2可通过下述两种方法制备金属钛:
“方法一”是电解TiO2来获得Ti(同时产生O2):将处理过的TiO2作阴极,石墨为阳极,熔融CaCl2为电解液,用碳块作电解槽池。
(3)阴极反应的电极反应式为___________________________________。
(4)电解过程中需定期向电解槽池中加入碳块的原因是______________________。
“方法二”是先将TiO2与Cl2、C反应得到TiCl4,再用镁还原得到Ti。因下述反应难于发生:
TiO2 (s)+2Cl2 (g) TiCl4(l)+O2 (g) ΔH=+151 kJ·mol-1
TiCl4(l)+O2 (g) ΔH=+151 kJ·mol-1
所以不能直接由TiO2 和Cl2反应(即氯化反应)来制取TiCl4。当往氯化反应体系中加入碳后,碳与上述反应发生耦合,使得反应在高温条件下能顺利进行。
(5)已知:C(s)+O2 (g) = CO2 (g) ΔH=-394 kJ·mol-1。请填空:
TiO2 (s)+C (s)+2Cl2 (g) = TiCl4 (l)+CO2 (g) ΔH= ______________
(6)从化学平衡的角度解释:往氯化反应体系中加入碳时,氯化反应能顺利进行的原因。
答:____________________________________________。
NO2溶于水生成HNO3和NO,工业上利用这一反应原理制取HNO3 。
3NO2+H2O=2HNO3+NO(第一次吸收)
但这一步NO2的吸收率只有2/3,还余下1/3的NO。为了更多地吸收NO2,工业上通常把生成的NO再次氧化为NO2,再次用水吸收
2NO+O2=2NO2(第一次通O2)
3NO2+H2O=2HNO3+NO(第二次吸收)
如此循环,可以使NO2全部转化为HNO3 。
现有3升NO2,如果按上述方法进行循环氧化吸收:
(1)则第二次吸收后,NO2的总吸收百分率为(可以用分数表示,下同),第二次通入O2的体积为升,第三次吸收后还剩余NO升。
(2)第n次吸收后剩余NO的体积为升(用含n的代数式表示)。
(3)如果要使3升N O2恰好完全转化为HNO3,则需通入O2的总体积为升。
O2恰好完全转化为HNO3,则需通入O2的总体积为升。
(所有气 体体积均在相同条件下测定)
体体积均在相同条件下测定)
已知A为金属单质,它们之间能发生如下反应(部分产物未标出):
请根据以上信息回答下列问题:
(1)写出物质B、D的化学式:BD;
(2)写出下列反应的化学方程式:
反应①;
反应②。
① A、B、C、D四种物质均含有元素X,有的还可能含有元素Y或者Z。元素Y、X、Z的质子数依次递增。② X在A、B、C、D中的化合价分别为0、-1、+1、+5。③室温下单质A与某种常见一元强碱溶液反应,可得到B和C。④化合物D受热催化分解,可制得元素Y的单质。请回答下列问题 :
:
(1) 写出元素X、Z的元素符号:X:,Z;
(2) 写出A、C的化学式:A,C;
(3) 写出③中反应的化学方程式;
(4) 写出④中反应的化学方程式。
Ⅰ.亚硫酸钠中+4价的硫,它既有氧化性又有还原性,现在有试剂:新制氯水、硫化钠溶液,NaOH溶液、氯化钡溶液、稀硫酸。要证明亚硫酸钠具有还原性,除亚硫酸钠外还应选用的试剂有,看到的现象是,反应的离子方程式;
Ⅱ.A、B、C是三种中学常见的有色物质,摩尔质量依次增大,他们均能与水发生氧化还原反应,但水既不是氧化剂也不是还原剂,请写出A、B、C与水反应的化学方程式:
(1)A+H2O
(2)B+H2O
(3)C+H2O
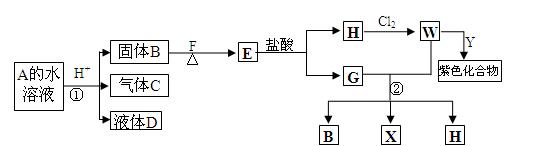
从某A的水溶液出发,有下图一系列变化(参加反应的水和生成的水均没有表示),已知D的焰色反应为紫色。
⑴写出化学式:A ▲ E ▲ Y ▲
⑵写出①、②反应离子方程式 ▲ , ▲
⑶Y有毒,含Y水溶液可加W检验其存在。还可向其水溶液中滴加 ▲ 检验其存在,该反应的化学方程式为: ▲