现有部分短周期元素的性质或原子结构如下表:
| 元素编号 |
元素性质或原子结构 |
| T |
M层电子数比K层电子数多4个 |
| X |
最外层电子数是次外层电子数的2倍 |
| Y |
常温下单质为双原子分子,其氢化物水溶液呈碱性 |
| Z |
元素最高正价是+7价 |
(1)元素T位于元素周期表的第______周期第_____族。写出T2-的原子结构示意图______________。
(2)元素Y氢元素形成一种离子YH4+,写出该微粒发生水解反应的离子方程式 。
(3)元素Z与元素T相比,非金属性较强的是 (用元素符号表示),下列表述中能证明这一事实的是 。
a 常温下Z的单质和T的单质状态不同
b Z的氢化物比T的氢化物稳定
c 一定条件下Z和T的单质都能与氢氧化钠溶液反应
(4)探寻物质的性质差异性是学习的重要方法之一。T、X、Y、Z四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是 (填化学式)。
下图中A~G是化合物,A是一种正盐,H是一种无色气态单质,C在高温下是气体,而常温下是一种无色液体, E为含钠的化合物。它们之间有如下转化关系: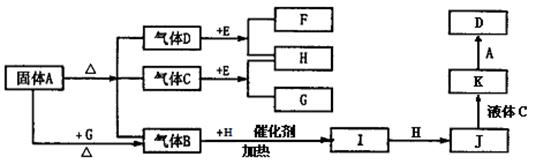
(1)实验室检验A的阳离子的一种方法为
。
(2)K的浓溶液与碳单质反应的化学方程式,B与H催化氧化的化学方程式。上述转化中,属于氧化还原反应,且氧化剂和还原剂是同种物质的反应有个。
(3)K的稀溶液中通入SO2气体,发生的化学反应的离子方程式为
。
(4)H气体与H2S气体以4:5的体积比混合,电火花点燃后充分反应,发生反应的总的化学反应方程式为。
(5)标准状况,将J与H按7:1的体积比充满烧瓶,将其倒置于盛有足量水的水槽中(假设进入烧瓶中的液体不扩散),实验结束后,烧瓶中溶液的物质的量浓度是mol/L(计算结果保留3位小数)。
现有A、B、C、D、E、F六种短周期元素,它们的原子序数依次增大,D与E是同族元素,且D最外层电子数是次外层电子数的3倍。A、B的最外层电子数之和与C的最外层电子数相等,A能分别与B、C、D形成电子总数相等的分子,且A与D可形成的化合物,常温下均为液态。请回答下列问题(填空时用化学符号作答):
(1)BC-的电子式为;元素F在周期表中的位置为。
(2)最近意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的C4分子。C4分子结构如右图所示。根据以上信息和数据,下列说法正确的是。
A.C4属于一种新型的化合物 B.C4与C2互为同素异形体
C.C4稳定性比P4(白磷)差 D.C4与C2互为同位素
(3)A与C两种元素可形成多种化合物分子,其中CA3分子的分子的空间构型为
,键角;C2A4分子的结构式为。
(4)为了除去化合物A2ED4稀溶液中混有的A2ED3,常采用A2D2为氧化剂,发生反应的离子方程式为。
(5)E与F形成的化合物E2F2在橡胶工业上有重要用途,遇水易水解,其空间结构与A2D2极为相似。对此以下说法正确的是
A.E2F2的结构式为:F-E—E-F B.E2F2在一定条件下,有氧化性或还原性
C.E2F2中的两各E原子的化合价分别为0价和+2价
D.E2F2与H2O反应的化学方程式可能为:2E2F2+2H2O=EO2↑+ 3E↓+4HF
(6)B与D可形成两种常见化合物,其中一种化合物BD2是分子(填“极性”或“非极性”)。在1000mL0.1mol/L的Ca(OH)2物质的水溶液中逐渐通入BD2并充分搅拌,溶液中析出沉淀的质量发生变化,在右图中画出沉淀质量随通入BD2的物质的量的变化曲线。
 |
向盛有KI溶液的试管中滴加氯水后再加入少许CCl4,充分振荡后CCl4层呈紫色。如果继续向试管中滴加氯水,充分振荡,CCl4层又会逐渐变浅,最后变成无色。根据以上信息完成下列填空:
(1)写出并配平CCl4层由紫色变成无色的化学反应方程式,并用双线桥法标出电子转移的方向和数目: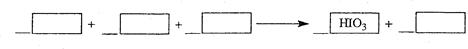
(2)实验中的有机溶剂CCl4还可以用代替。
| A.苯 | B.煤油 | C.酒精 | D.醋酸 |
(3)若把KI换成KBr,则CCl4层变为色;继续滴加氯水,CCl4层的颜色没有变化。则Cl2、HIO3、HBrO3氧化性由强到弱的顺序是。
(4)加碘盐中含碘量为20mg~50mg/kg。制取加碘盐(含KIO3的食盐)1000kg,若用KI与Cl2反应制KIO3,至少需要消耗Cl2________L(标准状况,计算结果保留1位小数)。
(11分)
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是________________;
(2)X与金属钠反应放出氢气,反应的化学方程式是
(有机物用结构简式表达);
(3)X与空气中的氧气在铜或银催化下反应生成Y,所发生反应的化学方程式为,Y中所含官能团的名称为_______;
X、Y、Z、W、Q是原子序数依次增大的短周期主族元素,X、W在周期表中的相对位置如下表;X元素最低负化合价的绝对值与其原子最外层电子数相等;Z是地壳中含量最多的金属元素。
(1)元素Q在周期表中位于第_____族,Z的离子结构示意图为_____。
(2)Z、W、Q的原子半径由大到小的顺序为。(用元素符号表示其原子)。
(3)X和氢组成的化合物分子中有6个原子,其结构简式为______,写出该物质与水加成的化学方程式。
(4)Y的最简单气态氢化物甲的水溶液显碱性
①用电离方程式表示氢化物甲的水溶液中的显碱性的原因,
②在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为______。该反应的氧化剂是当有1mol甲参加反应时,电子转移mol。
③Y的最简单气态氢化物甲和Q的氢化物乙反应生成正盐的电子式,
该化合物中所含化学键类型是,该化合物属于晶体。