如图所示为短周期的一部分,如果B原子和C原子的核外电子总数之和为A的4倍,则A的原子序数为_______,B为(填元素符号,下同)_____ ____,C为____________。
画出A的原子结构示意图:__________________,C的离子结构示意图:__________________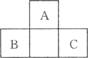
用电子式表示C的氢化物分子的形成过程:
(14分)常用于分离和提纯的物理方法有:
A萃取分液法 B结晶法 C分液法 D蒸馏法 E过滤法
(1)选择实验方法分离下列物质,将分离方法(填字母)填在横线上
①________分离饱和食盐水与沙子的混合物。
②________分离水和汽油的混合物。
③________分离四氯化碳(沸点为76.75 ℃)和甲苯(沸点为110.6 ℃)的混合物。
④________从碘的水溶液里提取碘。
⑤________从硝酸钾和氯化钠的混合液中获得硝酸钾。
(2)分离②和④时均使用的一种仪器在另三种实验方法中无需使用,这种仪器是_______。
(3)上述五种实验方法中,需使用酒精灯的有________(填数字编号)。
牛奶放置时间长了会变酸,这是因为牛奶中含有不少乳糖,在微生物的作用下乳糖分解而变成乳酸。乳酸最初就是从酸牛奶中得到并由此而得名的。乳酸的结构简式为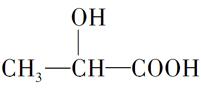 。完成下列问题:
。完成下列问题:
(1)写出乳酸分子中官能团的名称:______、______。
(2)写出乳酸与足量金属钠反应的化学方程式:
_____________________________________________________。
(3)写出乳酸与碳酸钠溶液反应的化学方程式:
_____________________________________________________。
(4)乳酸在浓硫酸作用下,两分子相互反应生成链状结构的物质,写出此生成物的结构简式:
_________________________________。
通过粮食发酵可获得某含氧有机化合物X,其相对分子质量为46,其中碳的质量分数为52.2%,氢的质量分数为13.0%。
(1)X的分子式是______________________。
(2) X与空气中的氧气在铜或银催化下反应生成Y,Y的结构式是________________________。
写出下列各烷烃的分子式。
(1)烷烃A在同温同压下蒸气的密度是H2的36倍________。
(2)烯烃B的分子中含有200个氢原子________。
(3)分子中含有22个共价键的烷烃________。
已知有如下转化关系:①C2H5OH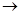 CH3CHO、②C2H4
CH3CHO、②C2H4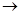 C2H5Br、
C2H5Br、
③C2H5OH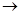 C2H4则反应①、②、③的反应类型分别为 ①、②、③。
C2H4则反应①、②、③的反应类型分别为 ①、②、③。