海水中可提取多种化工原料,下面是工业上对海水的几项综合利用示意图。
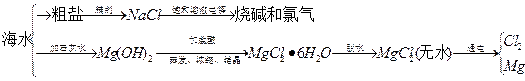
根据示意图回答下列问题:
(1)粗盐中含有Ca2+、Mg2+、SO42-等杂质离子,精制时所用试剂为盐 酸、BaCl2溶液、NaOH溶液、Na2CO3溶液,加入试剂的顺序是 、 、 、 。
(2)电解饱和食盐水的总反应的化学方程式为 。
(3)工业上MgCl2·6H2O晶体在 气氛中加热脱水,通入此种气体的作用是 。
.已知:CuI是难溶于水的白色固体。氧化性Cu2+>I2> Cu+,还原性Cu>I-> Cu+
(1)根据物质氧化性还原性的强弱推测,在溶液中Cu2+和I-反应的产物是、;
(2)久置于空气中的HI溶液呈黄色,向其中加入一些铜粉,可使溶液黄色消失,反应的化学方程式为_______________________;
(3)欲消除(2)中HI溶液的黄色,也可向其中通入少量H2S,这是因为当浓度接近时,还原性H2S_______(填“>”、“<”、“=”)I-;与加入铜粉的方法相比,用此方法得到的HI溶液浓度________(填“高”、“低”、“相等”);
(4)CuI可用于监测空气中是否含有汞蒸气:4CuI(白色)+Hg=Cu2HgI4(亮黄色)+2Cu。下列关于该化学方程式的说法错误的是_____________。
a.该反应被氧化的元素是铜元素和汞元素
b.该反应的氧化剂为CuI
c.Cu2HgI4既是氧化产物又是还原产物
A、B、C、D、E、F六种物质的相互转化关系如下图所示(反应条件未标出),其中反应①是置换反应。
(1)若A是常见的金属单质,D、F是气态单质,反应① 在水溶液中进行,则反应②(在水溶液中进行)的离子方程式是_____________________________。
(2)若B、C、F都是气态单质,且B有毒,③的反应中还有水生成,反应②需要放电才能发生,A、D相遇有白烟生成,则A、D反应产物的电子式是_________________,反应③的化学方程式是______________________________。
(3)若A、D、F都是短周期元素组成的非金属单质,且A、D所含元素同主族,A、F所含元素同周期,则反应①的化学方程式是。
列举物质B的一个重要用途。
18.(1)有以下八种饱和溶液:①Ba(NO3)2;②Ca(OH)2;③Ca(ClO)2;④CaCl2;⑤Na2CO3;⑥NaAlO2;⑦NH3和NaCl;⑧Na2SiO3。向其中分别持续通入CO2,最终能得到沉淀或析出晶体的是_________________________。
① 联氨(N2H4)是一种无色可燃的液体,溶于水显碱性,其原理与氨相似,但其碱性不如氨强,写出其溶于水呈碱性的离子方程式:。
② 联氨(N2H4)是航天飞船常用的高能燃料。联氨可以采用尿素[CO(NH2)2]为原料制取,方法是在高锰酸钾催化剂存在下,尿素[CO(NH2)2]和次氯酸钠、氢氧化钠溶液反应生成联氨、碳酸钠、另一种钠盐和水,写出其反应的化学方程式。
(18分)为了除去KCl溶液中少量的MgCl2、MgSO4,从稀盐酸、Na2CO3、Ba(NO3)2、K2CO3、Ba(OH)2溶液中,选择A、B、C 3种试剂,按图中的实验步骤进行操作:
(1)3种试剂的化学式:A________,B________,C________。
(2)加过量A的原因是____________,
有关反应的化学方程式为__________________________ _________________________
(3)加过量B的原因是____________,
有关反应的化学方程式为
(Ⅰ)A、B、C三种无色可溶性盐分别是由Na+、Ag+ 、Ba2+、Cl—、NO3— 、CO32—中不同的阴、阳离子所组成。经实验A溶液、B溶液均可以与盐酸反应,其中A产生白色沉淀,B产生气泡。则A为、B为。将B和C的溶液混合反应的化学方程式为:。
(Ⅱ)有一包固体粉末,由CaCO3、Na2SO4、KNO3、BaCl2、CuSO4中的三种物质组成,取样品进行如下实验:
从实验可以判断,该固体粉末中一定不含有,
它的组成可能是或。